
| A��FeSO4������Һ��¶�ڿ����У�4Fe2++O2+4H+�T4Fe3++2H2O | ||||
| B������ʯ��ˮ��̼����Ʒ�Ӧ��Ca2++2HCO3-+2OH-�TCaCO3��+CO32-+2H2O | ||||
C��H
| ||||
| D�����Ȼ�����Һ�еμӹ�����ˮ��Al3++4NH3?H2O�TAlO2-+4NH4++2H2O |
18 2 |
18 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����֪C��s��+O2��g��=CO2��g������H1C��s��+
| ||
| B���к��ȡ�H=-57.3kJ?mol-1������1.00L 1.00mol?L-1H2SO4��ϡ��NaOH��Һǡ����ȫ��Ӧ�ų�57.3kJ������ | ||
| C���õ������0.50mol?L-1���ᡢ0.55mol?L-1NaOH��Һ�����к��Ȳⶨ��ʵ�飬��ʹ��õ�ֵƫ�� | ||
| D����101KPaʱ��1molCH4��ȫȼ������CO2��ˮ�����ų�����������CH4��ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ |
| B������M+N=X+Y��Ϊ���ȷ�Ӧ����1mol X��1mol Y��������һ������1mol M��1mol N�������� |
| C����H2��g��+Cl2��g��=2HCl��g������H=-183kJ/mol����ʾ1����H2��1����Cl2��Ӧ���ų�����183kJ |
| D����ѧ��Ӧ��Ȼ����ѧ���ı仯����ѧ��ӦҲ��Ȼ���������ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ݣ�����H2��I2�ٷֺ������� |
| B�����£�ѹ�������ƽ�ⲻ�ƶ�����ɫ���� |
| C�����ݣ����£�����Ӧ���ʼ�С |
| D����ѹ������HI����ʼʱ����Ӧ���ʼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��11��1 | B��9��2 |
| C��12��11 | D��9��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCl��Cl2 | ||
| B��Fe��Fe3+ | ||
| C��KClO3��O2 | ||
D��MnO
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
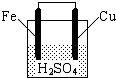
| A�������Ǹ���������������Ӧ |
| B��ͭ����������ų� |
| C��������пƬ����������ͭƬ |
| D������ܷ�Ӧ����ʽ�ɱ�ʾΪ��Fe+2H+=Fe2++H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com