
(10分)有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置 。
⑵元素A的非金属 (填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子 (填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式 。
⑸氧化铜与D的单质在高温下发生化学反应的方程式
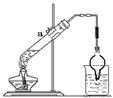
,若得到1mol氧化产物,则该反应转移电子 mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因 。
⑴第三周期ⅢA族 ⑵< ⑶> ⑷ ⑸3CuO+2Al
⑸3CuO+2Al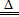 Al2O3+3Cu
6 由于酒精灯一直在加热,随着反应进行,反应生成的水不断蒸发,Cu和硫酸的反应在持续进行,而Cu和H2SO4的物质的量之比又恰好是1:2。
Al2O3+3Cu
6 由于酒精灯一直在加热,随着反应进行,反应生成的水不断蒸发,Cu和硫酸的反应在持续进行,而Cu和H2SO4的物质的量之比又恰好是1:2。
【解析】
试题分析:根据“A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小”,可以确定,E为第一周期,H;A、B、C为第二周期;E为第三周期。“A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半”,可以确定C的最外层电子数为偶数,D为奇数,又因为A、B、C与H结合为10电子物质,确定A、B、C为C、N、O;D为Al。最终确定A、B、C、D、E依次为C、N、O、Al、H。
(1)铝核外有三个电子层,最外层有3个电子,铝在周期表中的位置是第三周期第IIIA族。
(2)C和O都是第二周期元素,从左向右,非金属增强。
(3)电子层结构相同的离子,核电荷数越大,离子半径越小。
(4)C和H组成的10电子分子为甲烷分子。
(5)铝和氧化铜高温下发生铝热反应,方程式为3CuO+2Al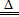 Al2O3+3Cu,若得到1mol氧化铝,转移电子6mol。铜与硫酸物质的量比为1:2,反应持续加热,水不断蒸发,铜与浓硫酸可完全反应。
Al2O3+3Cu,若得到1mol氧化铝,转移电子6mol。铜与硫酸物质的量比为1:2,反应持续加热,水不断蒸发,铜与浓硫酸可完全反应。
考点:原子结构 元素周期律 元素及其化合物
点评:熟记1~18号元素符号及其名称。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
32 16 |
32 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com