
| A、25℃时,AgCl的溶解度小于Ag2S的溶解度 |
| B、在25℃的AgNO3溶液中,AgCl的溶解度、Ksp均减小 |
| C、25℃时,在AgCl悬浊液中加入0.1mol?L-1 Na2S溶液,搅拌,生成Ag2S沉淀 |
| D、若取0.144g的AgCl放入100mL水中(忽略溶液体积的变化),则溶液中c(Cl-)=1.0×10-2 mol?L-1 |
| 1.8×10-10 |
| 1.8×10-10 |


科目:高中化学 来源: 题型:
| A、用带玻璃塞的试剂瓶保存Na2CO3溶液 |
| B、配制FeCl3溶液时,向溶液中加入少量铁粉和稀盐酸 |
| C、在铁件表面镀铜时,用铁件作阴极、铜作阳极、稀硫酸作电镀液 |
| D、实验室进行肥皂反应时,在油脂和氢氧化钠的混合液中加入适量酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
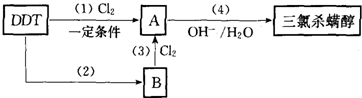
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上常用热的纯碱溶液去除油污 |
| B、接外加电源的正极以保护海水中的钢闸门 |
| C、锅炉水垢中含有的CaSO4可用Na2CO3溶液处理转化为疏松且易溶于酸的CaCO3 |
| D、太阳能、氢能和生物质能等很可能成为未来的主要能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | - |
| C6H5OH(苯粉) | C5H5OH?C6H5O-+H+ | 1.1×10-10 | |
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42-(aq) | - | 1.07×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32-(aq) | - | 2.58×10-9 |

查看答案和解析>>
科目:高中化学 来源: 题型:
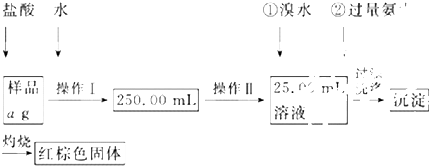
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com