
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是
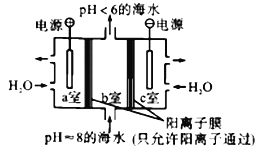
A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
科目:高中化学 来源: 题型:
【题目】采用乙烯与甲苯为主要原料,按下列路线可合成有机物E、F:
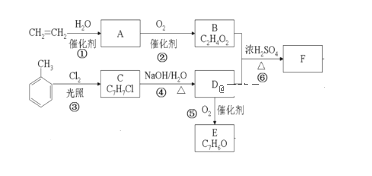
请回答:
(1)B中官能团的名称是_____,反应④的反应类型是_____。
(2)F的结构简式______________。
(3)反应①的化学方程式是___________,反应⑤的化学方程式是_________。
(4)下列有关说法不正确的是________。
A.![]() 不能使酸性KMnO4溶液褪色
不能使酸性KMnO4溶液褪色
B.E能与新制的Cu(OH)2悬浊液发生反应,但B不能
C.1molE和足量H2反应,最多消耗4molH2
D.D的同分异构体中能与NaOH溶液发生反应的有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组:同分异构体的书写
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式________,其中一氯代物只有2种的结构简式为:_______________________。
(2)写出符合下列条件 的所有同分异构体的结构简式_______。
的所有同分异构体的结构简式_______。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)CH2=CHOC2H5的同分异构体,与CH2=CHOC2H5有完全相同的官能团,写出所有可能的结构________。
学法题:通过此题的解答,总结同分异构体常见类型有____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________;锑在元素周期表中的位置为__________。
(2)![]() 中子数与质子数的差值为________。
中子数与质子数的差值为________。
(3)酸性:H3AsO4__H3PO4(填“>”或”<”)请从元素性质角度解释原因_______。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1 mol苯分子中含有C=C双键数目为3NA
B.标准状况下,11.2L CH3Cl中含有的共价键数目为2NA
C.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
D.17 g甲基(﹣14CH3)所含中子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
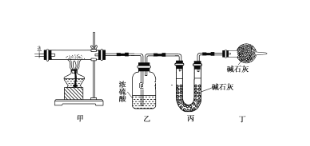
(1)请完成下列实验步骤:
①称取3.65 g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中________________(填现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是___________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____________(填字母)连接在________(填装置连接位置)。
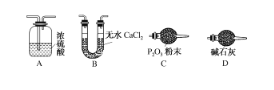
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
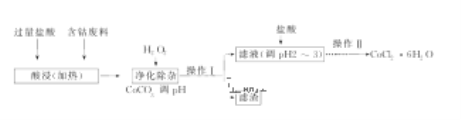
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为___________________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________。
③加盐酸调整pH为2~3的目的为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G、H是周期表中前四周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
H | H是与D相邻的同主族元素,且原子半径:H>D |
(1) B元素符号为________ ,A与C以原子个数比为1:1形成的化合物的电子式为_______ ,用电子式表示C与E形成化合物的过程________ 。
(2) A、C、E所形成简单离子半径由大到小的顺序是____________ ,H的最高价氧化物对应水化物的化学式为_________ ,A、D、H的氢化物的沸点由高到低的顺序为____________________ 。
(3) 非金属性D_________ E(填“大于”或“小于”)。下列事实能证明这一结论的是________ (选填字母序号)。
a.E的熔点低于D
b.氢化物的还原性:D > E
c.最高价氧化物对应的水化物酸性:E > D
d.氢化物的酸性:E >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
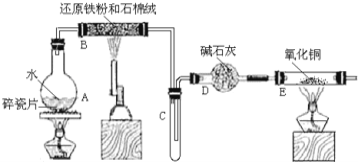
(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com