
【题目】如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。A的电极反应为________。最终可观察到的现象是________________。
(2)打开K1,合并K2。F极的电极反应为_______,检验F极产生气体的方法是____________。
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是_____,原因是____________。
【答案】O2+2H2O+4e-=4OH- 溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色 2Cl--2e-=Cl2↑ 用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气; A、E 因为A极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性
【解析】
当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,石墨作正极,发生吸氧腐蚀,当打开K1,闭台K2时,铁片、石墨和NaCl溶液,构成电解池,说明作阳极,铁作阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,可以用湿润的淀粉碘化钾试纸检验氯气。
(1)打开K2,闭合K1后,构成原电池,B是铁片,作负极,A是正极,由于溶液是氯化钠溶液,因此相当于铁的吸氧腐蚀,正极反应式为O2+2H2O+4e-=4OH-。铁失去电子生成亚铁离子,然后结合OH-生成Fe(OH)2沉淀,最终被氧化生成氢氧化铁沉淀,实验现象为溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色,故本题答案为: O2+2H2O+4e-=4OH-;溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色;
(2)打开K1,闭合K2,装置是电解池,F是阳极,E是阴极,阳极氯离子放电,生成氯气,电极反应式为:2Cl--2e-=Cl2↑,可利用氯气的氧化性来检验,即生成了碘单质,用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气,故本题答案为:2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气;
(3)由(1)、(2)分析可知,OH-在A和E两极出现,酚酞遇OH-变红,所以溶液变红,故本题答案为:A、E;因为A极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
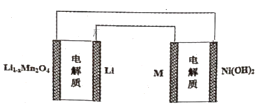
【题目】2019年诺贝尔化学奖授予了约翰古迪纳夫等三位科学家,以表彰他们在锂离子电池研发领域作出的贡献。某充电宝锂离子电池的总反应为:xLi++Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池的总反应为:NiOOH+MH
LiMn2O4,某手机镍氢电池的总反应为:NiOOH+MH![]() M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
A.锂离子电池充电时Li+向阴极迁移
B.如图表示用锂离子电池给镍氢电池充电
C.镍氢电池充电时,阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原
D.锂离子电池放电时,正极的电极反应式:Li1-xMn2O4+xLi++xe-=LiMn2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
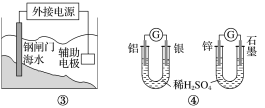
【题目】关于下列各装置图的叙述不正确的是( )
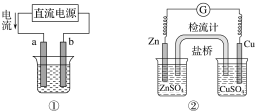
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物 ![]() 和
和 ![]() 的说法正确的是( )
的说法正确的是( )
A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D. ![]() 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无水FeCl3能与氯苯反应:2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,实验室利用该装置制备无水FeCl2并检测FeCl3的转化率。已知:C6H5Cl、C6H4Cl2沸点依次为132℃、173℃。如图为制备FeCl2装置(加热和加持仪器省略)
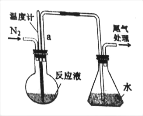
(1)蒸干并灼烧FeCl2溶液最终得到_____
(2)导管a的作用是_____;反应前通入N2的作用是_____;
(3)锥形瓶的作用是_____;该装置的不足之处为_____。
(4)反应结束后,回收过量氯苯的操作方法名称是_____。
若32.500g无水FeCl3与过量氯苯充分反应后将锥形瓶内溶液配制成250mL溶液,量取其中25.00mL溶液,滴加指示剂后,用0.4000mol/L的NaOH溶液滴定,重复三次,达到滴定终点平均消耗19.60mLNaOH溶液。
(5)滴定终点的现象是_____。
(6)FeCl3的转化率(转化量占总量的百分率)为_____%。
若制备反应后未通入足量N2,测定结果会_____(选项:偏高、偏低或不影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
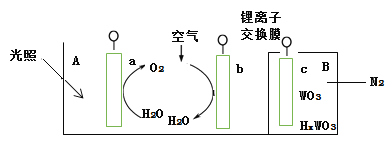
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F可用于某抗凝血药的制备,工业生成F的一种路线图如下(其中H与FeCl3溶液能发生显色反应):
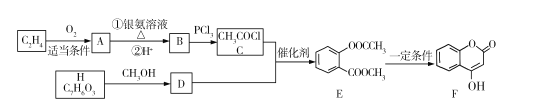
回答下列问题:
(1)A的名称是 ___,E中的官能团是名称是____。
(2)B→C的反应类型是 ___,F的分子式为____。
(3)H的结构简式为 ___。
(4)E与NaOH溶液反应的化学方程式为 ___。
(5)同时满足下列条件的D的同分异构体共有____种,写出核磁共振氢谱有5组峰的物质的结构简式 ___
①是芳香族化合物
②能与NaHCO3溶液反应
③遇到FeCl3溶液不显色
④1mol该物质与钠反应时最多可得到1molH2
(6)以2氯丙酸、苯酚为原料制备聚丙烯酸苯酚酯(![]() ),写出合成路线图(无机试剂自选)_________。
),写出合成路线图(无机试剂自选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. NaCl的摩尔质量是58.5gB. 64g氧气中含有2mol氧
C. 4g氦气中含有2mol氦原子D. 0.1molCO2中含有6.02×1022个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有19.2克铜与400毫升稀硝酸发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥表示出电子转移的方向和数目_____________
(2)计算稀硝酸的物质的量浓度_____________
(3)计算产生的气体在标况下的体积_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com