
分析 反应中N元素化合价由-3价升高到+2价,O元素化合价由0价降低到+2价,反应中O2为氧化剂,NH3为还原剂,结合化合价的变化解答该题.
解答 解:(1)反应中O元素得电子,化合价降低,N元素失电子,化合价升高,转移电子数目为20,电子转移的方向和数目可表示为 ,
,
故答案为: ;
;
(2)反应中O元素得电子,化合价降低,N元素失电子,化合价升高,被氧化,则反应中O2为氧化剂,NH3为还原剂,氧化产物为NO,
故答案为:O2;NO;
(3)设消耗的氨气为xg,
4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O
4×17 4×30
xg 120g
解得x=68g;
故答案为:68.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度不大,注意相关基础知识的积累.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
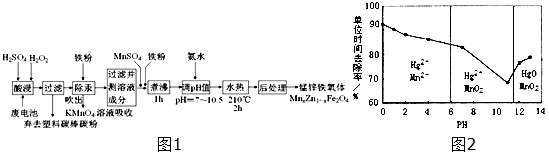
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| B. | 凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、F-、Cl- | B. | K+、Cl-、CO32- | C. | HCO3-、Ba2+、I- | D. | Na+、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
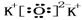 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com