
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了图1、图2两种实验装置. 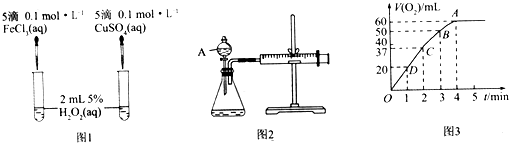
(1)若利用图1实验,可通过观察产生气泡的快慢定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 , 写出H2O2在二氧化锰催化作用下发生反应的化学方程式: . 若利用图2实验可进行定理分析,图中仪器A的名称为 , 实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是 .
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示,解释反应速率变化的原因: , H2O2初始物质的量浓度为(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:
在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5molL﹣1的硫酸,10s时收集到产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为molL﹣1s﹣1(假设反应前后溶液的体积不变).
【答案】
(1)消除阴离子不同对实验的干扰;2H2O2 ![]() ?2H2O+O2↑;分液漏斗;产生40mL气体所需的时间
?2H2O+O2↑;分液漏斗;产生40mL气体所需的时间
(2)随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L
(3)0.005
【解析】解:(1)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位,如果不恢复原位,则证明气密性良好,否则不好;根据v=
2H2O+O2↑,A仪器名称是分液漏斗,检验装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位,如果不恢复原位,则证明气密性良好,否则不好;根据v= ![]() 知,还需要测定产生40mL气体所需的时间,所以答案是:消除阴离子不同对实验的干扰;2H2O2
知,还需要测定产生40mL气体所需的时间,所以答案是:消除阴离子不同对实验的干扰;2H2O2 ![]() 2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2 ![]() 2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2 , H2O2的分解反应为2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2 , H2O2的分解反应为2H2O2 ![]() 2H2O+O2↑,则n(H2O2)=
2H2O+O2↑,则n(H2O2)= ![]() ×2≈0.00536 mol,c(H2O2)=
×2≈0.00536 mol,c(H2O2)= ![]() ≈0.11 mol/L,所以答案是:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
≈0.11 mol/L,所以答案是:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)
Zn | ~ | H2SO4 | ~ | H2 |
65g | 1mol | 22.4L | ||
0.13g | 0.002mol | 0.0448L |
用硫酸表示10s内该反应的速率为v= ![]() ÷10s=0.005molL﹣1s﹣1 , 所以答案是:0.005.
÷10s=0.005molL﹣1s﹣1 , 所以答案是:0.005.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是
A. 定容到刻度线时要使视线与凹液面的最低处水平相切
B. 用蒸馏水洗涤容量瓶后必须将容量瓶烘干
C. 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
D. 定容时不小心加水过量,用胶头滴管将水吸出即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是( )
A. MgCl2 + Ba(OH)2 == BaCl2 + Mg(OH)2↓
B. CO2 + 2NaOH == Na2CO3 + H2O
C. CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
D. 2H2+O2![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大.a为非金属元素,且a、e同主族,c、d为同周期的相邻元素.e原子的质子数等于c、d原子最外层电子数之和.b原子最外层电子数是内层电子数的2倍.c的气态氢化物分子中有3个共价键.试推断:
(1)写出b元素在周期表中的位置;
(2)写出一种由a、c、d所形成的离子化合物(化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;
(3)c的单质的电子式为 .
(4)b的最简单气态氢化物的结构式是
(5)b和d相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是(选填字母序号).
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。

填写下列空白:
(1)仪器a的名称____________。
(2)请写出a中发生主要反应的方程式____________。
(3)瓶b的作用有____________。请写出发生堵塞时瓶b中的现象____________。
(4)提纯d中粗产品的方法是____________。
(5)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示装置,为实现下列实验目的,其中Y端适合于作入口的是 .
A.瓶内盛液体干燥剂,用以干燥气体
B.瓶内盛液体洗涤剂,用以除去某气体中的杂质
C.瓶内盛水,用以测量某难溶于水的气体的体积
D.瓶内贮存气体,加水时气体可被排出
E.收集密度比空气大的气体
F.收集密度比空气小的气体.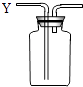
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为
Ⅳ.C(s)+O2(g)===CO2;
Ⅴ.CaCO3(s)===CaO(s)+CO2(g)。
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气(H216O),达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为________;向该容器中补充a mol炭,水蒸气的转化率将________(填“增大”、“减小”或“不变”),再补充a mol水蒸气(H218O),最终容器中C16O和C18O的物质的量之比为__________。
(3)已知反应Ⅱ的ΔH=-41.1 kJ/mol,C≡O 、O—H、H—H键的键能分别为1072.9 kJ/mol,464 kJ/mol、436 kJ/mol,则C=O的键能为________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡________移动(填“向右”、“向左”或“不”);当重新平衡后,CO2浓度________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com