
用11.6mol·L-1的盐酸和MnO2微热制取氯气,当生成的氯气为11.2L(标准状况)时,被氧化的氯化氢相当的溶液的体积为________mL,转移的电子的物质的量为________.
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围 (pH) |
各范围内颜色 | ||
| 前 | 中间 | 后 | ||
| 甲基橙 | 3.1~4.4 | 红 | 橙色 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 紫色 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 粉红 | 红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将②溶液用蒸馏水稀释,使体积扩大十倍,所得溶液pH变为a-1 | B、V1L③和V2L④混合,若混合后溶液pH=3,则V1:V2=11:9 | C、①与④等体积混合后,混合液pH=7 | D、①与③两溶液的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源:山西模拟 题型:问答题
| 1 |
| 2 |
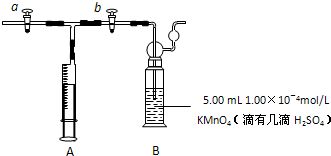
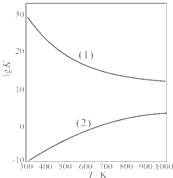
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省安阳市汤阴一中高二(上)期末化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com