
【题目】已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
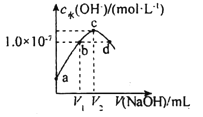
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
【答案】C
【解析】
A.若加入NaOH溶液的体积为10mL,NaOH与H2A反应恰好生成NaHA,HA-可以电离也可以水解。HA-的电离平衡常数K2=5.0×10-7,HA-的水解平衡常数![]() ,HA-的电离能力大于水解,则NaHA溶液显酸性,会抑制水的电离,则水电离c(OH-)<10-7mol·L-1。根据图示,b点水电离出来的c(OH-)=10-7mol·L-1,则加入的NaOH应大于10mL,则V1>10mL。c点水电离出来的c(OH-)最大,则溶液中只有盐,溶质只有Na2A,V2=20mL。A错误;
,HA-的电离能力大于水解,则NaHA溶液显酸性,会抑制水的电离,则水电离c(OH-)<10-7mol·L-1。根据图示,b点水电离出来的c(OH-)=10-7mol·L-1,则加入的NaOH应大于10mL,则V1>10mL。c点水电离出来的c(OH-)最大,则溶液中只有盐,溶质只有Na2A,V2=20mL。A错误;
B.a点为1mol·L-1的H2A,该二元酸电离程度较小,则c(H+)≈c(HA-),c(H2A)≈1mol·L-1,![]() ,可求得c(H+)≈0.01mol·L-1,pH=2,B错误;
,可求得c(H+)≈0.01mol·L-1,pH=2,B错误;
C.c点酸碱恰好完全反应生成正盐,则溶液中溶质为Na2A,A2-水解,A2-+H2O![]() HA-+OH-,溶液中c(OH-)≈c(HA-),水解较为微弱,则c(A2-)≈0.5mol/L,A2-的水解平衡常数
HA-+OH-,溶液中c(OH-)≈c(HA-),水解较为微弱,则c(A2-)≈0.5mol/L,A2-的水解平衡常数![]() ,又
,又![]() ,可得
,可得![]() ,带入数据,可求得c(OH-)≈10-4mol·L-1,溶液中的OH-均来自会水的电离,水电离出来的OH-和水电离出来的H+相等,则c点溶液水电离出来的c水(H+)≈10-4mol·L-1,C正确;
,带入数据,可求得c(OH-)≈10-4mol·L-1,溶液中的OH-均来自会水的电离,水电离出来的OH-和水电离出来的H+相等,则c点溶液水电离出来的c水(H+)≈10-4mol·L-1,C正确;
D.a点溶液为酸性,c点溶液为碱性,溶液从酸性转化到碱性过程中会有某处溶液为中性,其水电离出的c(OH-) =10-7mol·L-1,则b点溶液为中性。d点溶液为在c点溶液的基础上再加入NaOH溶液,则d点溶液为碱性,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
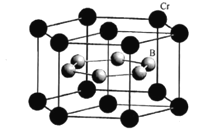
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:

由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯及其同系物是现代居室污染物的主要来源。回答下列问题:
(1)写出分子式为C6H6的一种含碳碳三键且无支链的链烃的结构简式:_________。
(2)已知1,3-环己二烯(![]() )脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
)脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
(3)苯的凯库勒式不能解释的事实是______(填字母)。
a.苯不能使溴水褪色
b.苯能与 H2发生加成反应
c.溴苯没有芳香族类同分异构体
d.邻二溴苯只有一种
(4)现代化学认为苯分子中碳碳之间的键是__________,故苯分子既能发生取代反应又能发生加成反应。
(5)甲苯是苯的同系物。甲苯_________(填“能”或“否”)使酸性高猛酸钾溶液褪色;甲苯与混合酸在加热条件下生成三硝基甲苯的反应方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.6g铁粉投入到盛有100mL2molL-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
A. v(H2SO4)=0.5mol (Lmin)-1B. v(H2SO4)=1 mol (Lmin)-1
C. v(Fe)=0.5mol (Lmin)-1D. v(FeSO4)=1mol (Lmin)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾离子电池资源丰富,在非水基电解液中具有更高的离子导电率等优点。一种钾离子电池的工作原理如图所示,已知该电池负极在KC24-KC16-KC8之间变化,正极在K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6之间变化,下列说法不正确的是( )
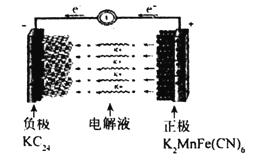
A.如图所示为钾离子电池的放电过程
B.放电时负极可发生反应:2KC8-e-=KC16+K+
C.充电时正极反应式为K2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.若充电前正负极质量相同,则充电时每转移0.lmole-,理论上正负极质量差将增加7.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→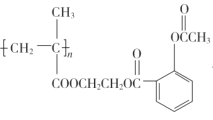 __。
__。
(4)满足以下条件的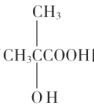 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(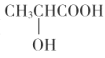 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成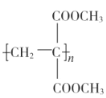 的路线:__。
的路线:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com