
分析 (1)①由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,据此配平书写反应方程式;
②根据氮元素守恒计算10g样品中含有AlN的物质的量,根据m=nM计算AlN的质量,再根据质量分数定义计算;
(2)反应后的溶液中加入氨水,使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n(HCl),再根据N原子守恒计算n(NH3),进而计算消耗氨水的体积.
解答 解:(1)①由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,根据元素守恒可知有水参加反应,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
②生成NH3的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据氮元素守恒可知10g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为$\frac{6.15g}{10g}$×100%=61.5%,
故答案为:61.5%;
(2)滤液稀释到1000mL,取出稀释液10mL,加入0.3mol•L-1的氨水使Al3+恰好完全沉淀,反应后的溶液中溶质为NH4Cl,根据氯离子守恒可知n(NH4Cl)=n′(HCl)=0.48mol×$\frac{10mL}{1000mL}$=0.0048mol,再根据N原子守恒可知n(NH3)=0.0048mol,
故需要氨水的体积=$\frac{0.0048mol}{0.3mol/L}$=0.016L=16mL,
答:需要氨水16mL.
点评 本题考查了有关化学方程式的计算,题目难度中等,注意把握过量计算与守恒思想的应用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定存在Br-、CO32- | B. | 溶液中可能存在NH4+ | ||
| C. | 溶液中一定不存在Fe2+、I-、SO32- | D. | 溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 是否均一、透明、稳定 | ||
| C. | 是否能透过滤纸或半透膜 | D. | 分散质微粒直径大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 过量空气有利于SO2转化为SO3 | ||
| C. | 打开汽水瓶盖,即有大量气泡逸出 | D. | 配置FeCl3溶液时,加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
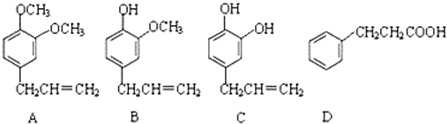
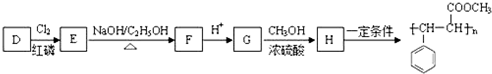
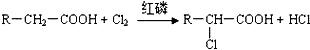
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com