
 2C(g)�ﵽƽ��ı�־����
2C(g)�ﵽƽ��ı�־����

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g) ��H<0��450��ʱ��n(SO3)��n(O2)��ʱ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����
2SO3(g) ��H<0��450��ʱ��n(SO3)��n(O2)��ʱ��ı仯��ϵ��ͼ��ʾ������˵����ȷ����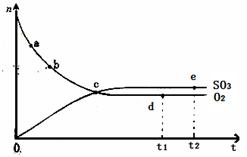
| A����c����Ӧ�ﵽƽ�� |
| B����a������Ӧ���ʱȵ�b�Ĵ� |
| C����d (t1ʱ��)�͵�e (t2ʱ��)��n(SO2)��һ�� |
| D�������������䣬600��ʱ��Ӧ��t1ʱ�̣�n(SO 3)����ͼ�е�d��ֵҪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
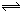 2M(g)+N(g) ��H��0����ƽ��״̬���¶ȣ�T����ѹǿ��P1>P2���Ĺ�ϵ��ͼ��ʾ��ͼ��y����ָ
2M(g)+N(g) ��H��0����ƽ��״̬���¶ȣ�T����ѹǿ��P1>P2���Ĺ�ϵ��ͼ��ʾ��ͼ��y����ָ
| A�����������ƽ����Է������� |
| B����������������ʵ���Ũ�� |
| C��L������������������ |
| D������������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��2NO2��g��  N2O4��g����H��0 N2O4��g����H��0 |
B��3O2��g�� 2O3��g����H��0 2O3��g����H��0 |
C��H2��g��+I2��g�� 2 H I��g����H��0 2 H I��g����H��0 |
D��NH4HCO3��s�� NH3��g��+H2O��g��+CO2��g����H��0 NH3��g��+H2O��g��+CO2��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 PCl5(g)�й��������£������жϲ���ȷ����
PCl5(g)�й��������£������жϲ���ȷ����| | PCl3(g) | Cl2(g) | PCl5(g) |
| ��ʼŨ��(mol/L) | 2.0 | 1.0 | 0 |
| ƽ��Ũ��(mol/L) | c1 | c2 | 0.4 |
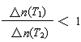
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
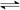 2NH3(g) ��H = -92 kJ��mol-1
2NH3(g) ��H = -92 kJ��mol-1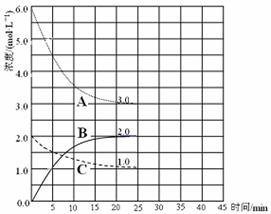
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2AB3(g) �ﵽƽ��ı�־��
2AB3(g) �ﵽƽ��ı�־��| A��������ÿ����1mol A2��ͬʱ����2mol AB3 |
| B��������ÿ����1mol A2��ͬʱ����3mol B2 |
| C��������A2��B2��AB3�����ʵ���֮��Ϊ1:3:2 |
| D��������A2��B2��AB3�����ʵ���Ũ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� ��
2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 NH3(g) + HI(g)
NH3(g) + HI(g) H2(g) + I2(g)
H2(g) + I2(g)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com