
| A、d>c>a>b |
| B、b>a>d>c |
| C、d>b>a>c |
| D、d>a>b>c |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
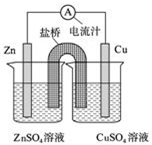
| A、原电池工作时的总反应为Zn+Cu2+═Zn2++Cu |
| B、原电池工作时,Zn电极流出电子,发生氧化反应 |
| C、若将Cu电极改为Fe电极,CuSO4溶液改为FeSO4溶液,Zn电极仍作负极 |
| D、盐桥中装有琼脂-饱和氯化钾溶液,则盐桥中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、减少O2的浓度能加快反应速率 |
| B、降低体系温度能加快反应速率 |
| C、使用催化剂不影响反应速率 |
| D、一定条件下达到反应限度时SO2部分转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将开采出的煤通过干馏、气化、液化等多种途径实现其综合利用 |
| B、氢气是清洁能源,工业上可用电解水法来开发氢能源 |
| C、向污水中投放明矾,利用生成的胶体净水:Al3++3H2O?Al(OH3)(胶体)+3H+ |
| D、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 |
| B、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝 |
| C、侯氏制碱是将先将CO2通入饱和氯化钠溶液中,然后通入NH3得碳酸氢钠固体,再灼烧制碳酸钠 |
| D、血液透析是利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
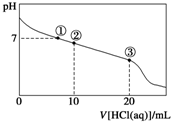 常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.100mol?L-1 CH3COONa溶液中逐滴加入0.1000mol?L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点①所示溶液中:c(CH3COOH)=c(Cl-)>c(Na+)>c(OH-)=c(H+) |
| B、点②所示溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH) |
| C、点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D、整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8g O2含有4NA个电子 |
| B、1L 0.1mol?L-1的氨水中有NA个NH4+ |
| C、常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA |
| D、1mol Na在空气中燃烧失去2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com