
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
分析 Si与氧气反应生成二氧化硅;
二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳;
NaHCO3、Na2SiO3均溶于水,然后通入足量二氧化碳,过滤;
二氧化硅不溶于水,NaCl溶于水,以此来解答.
解答 解:Si与氧气反应生成二氧化硅,则在空气中加热可除杂;
二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳,则通入饱和碳酸氢钠溶液、洗气可除杂;
NaHCO3、Na2SiO3均溶于水,然后通入足量二氧化碳,过滤,则溶液通入足量二氧化碳后,过滤、蒸发可除杂;
二氧化硅不溶于水,NaCl溶于水,则溶于水、过滤可分离,
故答案为:
| 混合物 | SiO2 (Si) | CO2(SO2) | NaHCO3(Na2SiO3) | SiO2(NaCl) |
| 除杂试剂 | 空气 | 饱和碳酸氢钠溶液 | 水、足量二氧化碳 | 水 |
| 除杂方法 | 加热 | 洗气 | 过滤、蒸发 | 过滤 |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答本题的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸滴入胆矾中,胆矾失水变白,发生了化学变化 | |
| B. | 二氧化硫能使溴水褪色,体现二氧化硫的漂白性 | |
| C. | 浓硫酸与灼热的木炭反应,体现浓硫酸的强氧化性和酸性 | |
| D. | 加热时硫与铜反应生成黑色的硫化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液的白色沉淀,又观察到颜色逐渐变为红褐色说明某溶液中一定含有Fe2+,一定不含有Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
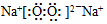 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com