
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
分析 对于共价化合物中元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,含有H原子一定不满足8电子结构,结合形成共价键数目判断.
解答 解:①BF3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构,故①错误;
②NCl3中N原子形成3个N-Cl键,N、Cl原子均满8电子结构,故②正确;
③PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构,故③错误;
④COCl2的结构式为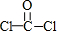 ,分子中C、O、Cl原子均满足8电子结构,故④正确;
,分子中C、O、Cl原子均满足8电子结构,故④正确;
⑤SF6中S原子形成6个S-F键,S原子最外层电子数为12,不满足8电子结构,故⑤错误;
⑥XeF2中Xe原子本身最外层有8个电子,且与F原子之间形成共价键,Xe原子最外层不满足8电子结构,故⑥错误;
⑦CS2 的结构式为S=C=S,C、S原子均满足8电子结构,故⑦正确;
⑧CH4 中H原子一定不满足8电子结构,故⑧错误;
⑨CF2Cl2中C原子形成2个C-F键、2个C-Cl键,均满足8电子结构,故⑨正确,
故选:B.
点评 本题考查8电子结构的判断,对应ABn型共价化合物,元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.


科目:高中化学 来源: 题型:选择题
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 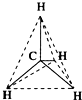 结构示意图 | B. |  电子式 | C. | 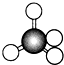 球棍模型 | D. | 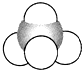 比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com