
【题目】如图所示,通电5min后,电极5的质量增加2.16g。假设电解过程中溶液的体积不变。

请回答下列问题:
(1)电源中a是_______极。A池中阳极的电极反应式为___________,C池中阴极的电极反应式为___________________________。
(2)通电5min后,如果B槽中共收集到224mL气体(标准状况),且溶液体积为200mL,则通电前溶液中Cu2+的物质的量浓度为___________________。
(3)如果A池溶液是200mL食盐水(假设电解液足量),则通电5min后,溶液的pH为__________。
【答案】 负 2Cl--2e- =Cl2↑ 2Ag++2e- =2Ag↓(或Ag++e- =Ag+) 0.025 mol·L-1 13
【解析】(1)如图所示,通电5min后,电极5的质量增加2.16 g,可知该电极上银离子放电,生成银2.16 g,即0.02 mol转移电子0.02 mol,且该电极是阴极,故电源a是负极,A池为电解池,阴极反应:2H++2e-=H2↑,阳极反应:2Cl--2e- =Cl2↑ ;C池为电解池,阴极反应:2Ag++2e- =2Ag↓;正确答案: 负 ; 2Cl--2e- =Cl2↑;2Ag++2e- =2Ag↓(或Ag++e- =Ag+)。
(2)通电5 minB槽中阳极氢氧根离子放电生成氧气0.02 mol÷4=0.005 mol即112 mL,因两极共收集气体224 mL,所以阴极生成氢气112 mL,转移电子0.01 mol,故铜离子得电子为0.01 mol,铜离子的物质的量是0.005 mol,溶液的体积为200mL,所以铜离子的物质的量浓度为0.005 mol÷0.2 L=0.025 mol/L ;正确答案:0.025 mol·L-1。
(3)当转移0.02 mol 电子时,由A池阴极反应可知,生成氢氧根离子0.02 mol,故溶液中氢氧根离子的浓度为0.02 mol÷0.2L=0.1mol/L,c(OH-)=0.1mol/L, c(H+)=10-13 mol/L,溶液的pH=13;正确答案:13。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法中正确的是( )
①棉花、蚕丝和聚乙烯的主要成分都是纤维素
②甲烷、乙醇和乙酸在一定条件下都能发生取代反应
③等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由多到少
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2CO3溶液振荡后,静置分液
⑤乙酸乙酯和植物油均可水解生成乙醇
⑥乙烯、苯、乙醇、油脂都能使酸性KMnO4溶液褪色
A. ①⑤⑥ B. ②③④ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是________(填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的________(填“正”或“负”)极相连。
(3)以该蓄电池作电源,用如图所示的装置进行电解,一段时间后发现溶液逐渐变浑浊,Al电极附近有气泡生成,写出此过程中阳极的电极反应式______________________ 。
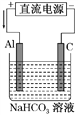
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据氧化还原反应2H2+O2===2H2O,设计成燃料电池,负极通的气体应是___________。
(2)如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是_____。

A.a电极是负极
B.b电极的电极反应为4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(3)根据氢氧燃料电池电解质溶液的不同,填写下表:
电解质溶液 | H2SO4溶液 | KOH溶液 |
负极反应 | ______________ | |
正极反应 | ___________ | |
溶液的pH变化 | _____________ |
(4)若把H2改为CH4,KOH溶液作电解质溶液,则负极反应为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
实验步骤 | 实验操作 |
Ⅰ | 取一定质暈的FeCO3固体置于 中,高温煅烧至质量不再减轻,冷却至室溫 |
Ⅱ | 取少量实验步骤Ⅰ所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)Ⅰ中横线处所需的化学仪器为______________________________________。
(2)写出实验步骤Ⅲ中发生反应的离子方程式_____________________________。
(3)乙同学提出不同看法:煅烧产物可能是Fe304,因为Fe304也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是___________________(填序号)。
a.氯水
b.氯水和KSCN溶液
c.酸性高锰酸钾溶液
(4)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是______________________________________。
(5)丙同学进一步査阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、_____________(填名称)和____________(填名称);再___________________(填操作名称),灼烧,即可得到Fe203。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
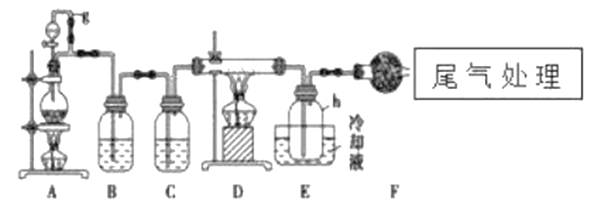
相关信息如下:
a.四氯化硅接触水会发生化学反应;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BC13 | A1C13 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:___________,D中发生反应的化学方程式___________。
(2)A中g管的作用是__________________,装置C中的试剂是___________,作用是___________。
(3)装置E中的h瓶需要冷却的理由是______________________。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是___________(填写元素符号)。
(5)过量的氯气可以用石灰乳来处理,请写出该反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能导电的是_______,属于电解质的是_________,属于非电解质的是_______。(填编号于空格中)
①铜 ②熔融的烧碱③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢硫酸中存在电离平衡:H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com