
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
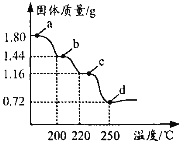
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:A(g)+3B(g)![]() 2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
2C(g) ,能确定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系的压强不再发生变化B.3v正(B)=2v逆(C)
C.混合气体密度不再变化D.消耗1molA的同时生成2molC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香子兰酸甲酯(甲)、甲醇、甲基丙烯酸甲酯(丙)、有机物(乙)、有机物(丁)存在下列转化关系,下列说法正确的是
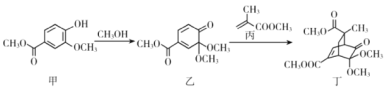
A.丙的分子式为C5H10O2B.乙→丁的反应类型为加成反应
C.乙、丁中的官能团种类均为3种D.甲的同分异构体中含有苯环且取代基与甲完全相同有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,反应原理如下图所示。下列说法错误的是
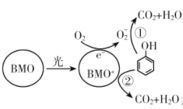
A.苯酚被氧化的总反应:C6H5OH+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.反应过程中BMO表现较强氧化性
C.在酸性条件下,反应①的离子方程式是3C6H5OH+28![]() +28H+=l8CO2↑+23H2O
+28H+=l8CO2↑+23H2O
D.过程①和②中被降解的苯酚的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是高能电池的理想负极,常用乙腈、二甲基甲酰胺等有机溶剂和LiC1O4、LlBF4、LiBr等电解质制成锂非水电池。回答下列问题:
(1)二甲基甲酰胺(![]() )中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
)中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
(2)LiClO4和LlBF4中都不存在的化学键是____(填代号)。
a.离子键 b.共价键 c.金属键 d.配位键
(3)LiX(X=F,Cl,Br,I)具有NaCl型晶体结构。当阴、阳离子电荷的绝对值相同且它们的半径相近时,生成的盐类一般难溶于水。由上述规则可以判断LiF、LiCl、LiBr、LiI中溶解度最小的是_______ 。
(4)Li2S属立方晶体,晶胞边长为dpm,晶胞截面图如下所示。每个晶胞中含有S2-的数目为_____,S2-的配位数是_______,NA表示阿伏加德罗常数的值,则Li2S晶体的密度为_______gcm-3(用代数式表示)。
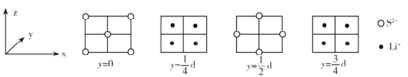
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______。
(3)容量瓶使用前检验漏水的方法是_______。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________;
②摇匀后发现液面低于刻度线再加水,_____________;
③容量瓶中原有少量蒸馏水,_______________;
④定容时观察液面俯视,_____________;
⑤未将洗涤液注入容量瓶中,_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某2.0L硫酸溶液中含有1.0mol H2SO4.试计算:
(1)溶液中H2SO4的物质的量浓度;
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况);
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.50g34%H2O2溶液中含H-O键的数目为NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com