
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
分析 a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族,可以判断a、b处于第二周期,c处于第三周期,a、c处在同一主族,二者质子数相差8,c原子核内质子数等于a、b原子核内质子数之和,故b的质子数为8,则b为O元素;c原子最外层上的电子数是d原子次外层电子数的一半,d不能处于第二周期,只能为第三周期元素,故c最外层电子数为4,则a为C元素,c为Si元素,d为Na或Mg或Al元素,据此解答该题.
解答 解:a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族,可以判断a、b处于第二周期,c处于第三周期,a、c处在同一主族,二者质子数相差8,c原子核内质子数等于a、b原子核内质子数之和,故b的质子数为8,则b为O元素;c原子最外层上的电子数是d原子次外层电子数的一半,d不能处于第二周期,只能为第三周期元素,故c最外层电子数为4,则a为C元素,c为Si元素,d为Na或Mg或Al元素.
A.a为C元素,c为Si元素,最外层电子数为4,处于周期表第ⅣA族,故A错误;
B.b为O元素,若d为Na元素,二者可组成化合物Na2O2,且阴阳离子个数比为1:2,故B正确;
C.Si单质可在氧气中燃烧生成SiO2,故C正确;
D.用来制作光导纤维的SiO2,故D错误;
故选BC.
点评 本题考查结构性质与位置的关系等,题目难度中等,正确推断元素的种类为解答该题的关键,根据原子序数与半径关系确定大体位置,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 实验室制备氢氧化铁胶体:Fe3++3H2O═Fe(OH)3(胶体)+3H+ | |
| D. | 向苯酚钠溶液中通入少量的二氧化碳气体:2C6H5ONa+CO2+H2O═2C6H6O+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.
(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应:2SO2(g)+O2(g)═2SO3(g),下列说法中,正确的是C.| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
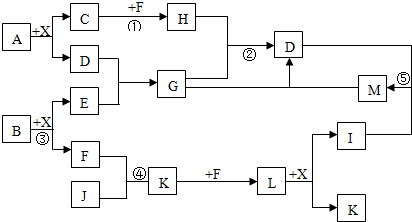
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
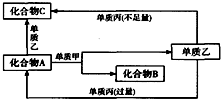 A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙在如图所示的转化关系(转化过程都不需要使用催化剂).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com