
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CCl4 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.NaCl、MgCl2、Na2O中金属元素和非金属元素之间只存在离子键,所以化学键类型相同,故A正确;
B.Na2O中金属元素和非金属元素之间只存在离子键,H2O、CO2中不同非金属元素之间只存在共价键,所以化学键类型不同,故B错误;
C.NaOH中存在离子键和共价键,CCl4、H2SO4中只存在共价键,所以化学键类型不同,故C错误;
D.NH4Cl中存在离子键和共价键,H2O、CO2中只存在共价键,所以化学键类型不同,故D错误;
故选A.
点评 本题考查了化学键的判断,明确物质的构成微粒及微粒间的作用力是解本题关键,注意:氯化钙中两个氯离子之间不存在化学键、氯化铵是全部由非金属元素组成的离子化合物,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 85g | B. | 79g | C. | 116g | D. | 58g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由不同种类的原子构成的物质不可能是单质 | |
| B. | 葡萄糖注射液不能产生丁达尔现象,不属于胶体 | |
| C. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
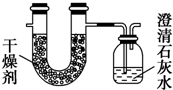 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲为小苏打,乙为纯碱 | |
| B. | 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 | |
| C. | 加热不久就能看到A烧杯的澄清石灰水变浑浊 | |
| D. | 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
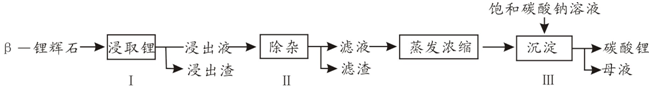
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)中SO2氧化性比HI强 | |
| B. | 循环过程中不需要补充H2O | |
| C. | 循环过程H2O作催化剂 | |
| D. | 循环过程中产生1mol H2的同时产生0.5mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com