
【题目】下列说法正确的是( )
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有共价键的晶体一定是分子晶体
D. 元素的非金属性越强,其单质的活泼性一定越强
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:

(1)写出下列元素的名称⑩________。
(2)在①~⑩元素中,金属性最强的元素是_______(填元素符号)。
(3)甲、乙是上述元素形成的两种气态氢化物,且甲、乙分子含有相同数目的电子,二者相互反应生成化合物丙,丙是离子化合物,且其阴、阳两种离子所含电子数都与甲、乙分子相同。若甲的相对分子质量比乙的小,则甲的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式_____________________________________________ ,丙中所含有的化学键类型有__________________________。
(4)元素⑤、⑥、⑨的最高价氧化物的对应水化物中,两两间能发生反应的有关离子方程式分别为_____________________________、 _____________________________ 。
(5)下列事实中,能够判断元素⑥、⑦的非金属性强弱的是_________。
a.元素⑥单质的熔点比元素⑦单质的熔点高
b.元素⑦的氢化物比元素⑥的氢化物稳定
c.元素⑥与⑨形成的化合物能与元素⑦的氢化物的水溶液反应,生成元素⑥的氢化物
d.一定条件下元素⑥和元素⑦的单质分别与Fe反应时,产物中铁元素的价态不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某同学利用日常用品注射器设计的简易实验装置。甲管中注入10 mL CH4,同温同压下乙管中注入50 mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管放在光亮处一段时间。

(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。
其中正确的是________。
(2)甲管中发生化学反应的类型为________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是______。
A.水 B.NaOH溶液
C.AgNO3溶液 D.饱和食盐水
(4)反应后,若将甲中的物质推入盛有适量AgNO3溶液的小试管中会观察到________,若再向其中滴入几滴石蕊试液,又观察到________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
(1)请写出FeCl3溶液与铜反应的化学方程式:______________________________________。
检验反应后的溶液中存在Fe3+的试剂常用硫氰化钾溶液,写出反应的离子方程式:_____________________。
II.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(2)沉淀A的成分是(填化学式)_________。
(3)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(4)步骤③中通入过量CO2气体的离子方程式是______________________;
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。

III.(6)某一反应体系有反应物和生成物共五种物质:O2 、H2CrO4 、Cr(OH)3 、H2O 、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
写出反应的化学方程式_____________________________________________,如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取滴定溶液体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热。决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示常温常压时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g) ![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1mol H2和1mol I2(g)反应生成2 mol HI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 2项 B. 3项 C. 4项 D. 5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下1 L的密闭容器中,反应mA(g)+nB(g) ![]() pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
(2)在其他条件不变的情况下,扩大容器体积,若平衡向逆反应方向移动,m+n______p+q(选填“>”、“<”或“=”),v逆______(选填“增大”、“减小”或“不变”)。
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是________。(选填编号,下同)
a.增大A的浓度 b. 缩小容器体积
c. 加入催化剂 d.升高温度
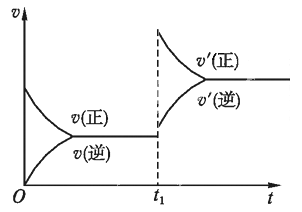
(4)若nV正(A)=mV逆(B),则该反应________。
a.向正反应方向进行 b. 向逆反应方向进行 c.处于平衡状态 d.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com