分析:(1)当向100mL 0.1mol/L的NaOH溶液中通入一定量的CO
2气体后,可能发生的反应有:2NaOH+CO
2═Na
2CO
3+H
2O或NaOH+CO
2═NaHCO
3两种可能的情况,通过图象关系,当向溶液中加盐酸的体积30mL时,无气体出现,说明此段内发生了如下反应:NaOH+HCl=NaCl+H
2O或HCl+Na
2CO
3═NaHCO
3+NaCl;当加入50mL盐酸时生成的二氧化碳达到最大量,反应结束,此时溶质为氯化钠,可以根据氯原子、钠原子守恒计算出消耗氯化氢的总物质的量,再根据c=
计算出该稀盐酸的浓度;
(2)生成二氧化碳气体的反应方程式为:NaHCO
3+HCl═CO
2↑+NaCl,根据图象可知生成二氧化碳总共消耗该稀盐酸20mL,根据n=cV计算出氯化氢的物质的量,再根据反应方程式计算出生成二氧化碳的物质的量,再根据V=nV
m计算出生成的标况下的二氧化碳的体积;
(3)反应生成二氧化碳气体前可能发生的反应有:Na
2CO
3+HCl═NaHCO
3+NaCl、NaOH+HCl=NaCl+H
2O,生成二氧化碳气体的反应为:NaHCO
3+HCl═CO
2↑+NaCl,
根据图象可知,反应生成二氧化碳气体前消耗了30mL盐酸,反应生成二氧化碳消耗了20mL盐酸,说明氢氧化钠溶液与二氧化碳反应后的溶液中溶质为NaOH和Na
2CO
3,
根据生成二氧化碳的物质的量及碳原子守恒可以计算出碳酸钠的物质的量,根据二者生成二氧化碳气体前消耗氯化氢的物质的量可以计算出氢氧化钠的物质的量,再根据c=
计算出二者的物质的量浓度.
解答:
解:(1)当向100mL 0.1mol/L的NaOH溶液中通入一定量的CO
2气体后,可能发生的反应有:2NaOH+CO
2═Na
2CO
3+H
2O或NaOH+CO
2═NaHCO
3两种可能的情况,通过图象关系,当向溶液中加盐酸的体积30mL时,无气体出现,说明此段内发生了如下反应:NaOH+HCl=NaCl+H
2O或HCl+Na
2CO
3═NaHCO
3+NaCl;当加入50mL盐酸时生成的二氧化碳达到最大量,反应结束,此时溶质为氯化钠,
根据氯原子、钠原子守恒可得:HCl~NaCl~NaOH,所以反应消耗盐酸的物质的量为:n(HCl)=n(NaOH)=0.1mol/L×0.1L=0.01mol,该稀盐酸的浓度为:c(HCl)=
=0.2mol/L,
答:该稀盐酸的物质的量浓度为0.2mol/L;
(2)生成二氧化碳气体的反应为:NaHCO
3+HCl═CO
2↑+NaCl,根据图象可知生成二氧化碳总共消耗该稀盐酸体积为:(50-30)mL=20mL,消耗氯化氢的物质的量为:n(HCl)=0.2mol/L×0.02L=0.004mol,
根据反应NaHCO
3+HCl═CO
2↑+NaCl可知,生成二氧化碳的物质的量为0.004mol,
标况下0.004mol二氧化碳的体积为:22.4L/mol×0.004mol=89.6mL,
故答案为:生成标况下二氧化碳的体积为89.6mL;
(3)反应生成二氧化碳气体前可能发生的反应有:Na
2CO
3+HCl═NaHCO
3+NaCl、NaOH+HCl=NaCl+H
2O,生成二氧化碳气体的反应为:NaHCO
3+HCl═CO
2↑+NaCl,
根据图象可知,反应生成二氧化碳气体前消耗了30mL盐酸,反应生成二氧化碳过程中消耗了20mL盐酸,说明滴加盐酸前溶液中所含溶质为NaOH和Na
2CO
3,
根据C原子守恒,碳酸钠的物质的量为:n(Na
2CO
3)=n(CO
2)=0.004mol,
0.004mol碳酸钠发生反应Na
2CO
3+HCl═NaHCO
3+NaCl消耗氯化氢的物质的量为:0.004mol,
则NaOH消耗氯化氢的物质的量为:0.2mol/L×0.03L-0.004mol=0.002mol,根据反应NaOH+HCl=NaCl+H
2O可知,反应消耗的氢氧化钠的物质的量为0.002mol,
则滴加盐酸前溶液中所含溶质的成分为Na
2CO
3、NaOH,浓度分别为:c(Na
2CO
3)=
=0.4mol/L,c(NaOH)=
=0.2mol/L,
答:滴加盐酸前溶液中所含溶质的成分为Na
2CO
3、NaOH,浓度分别为:c(Na
2CO
3)=0.4mol/L,c(NaOH)=0.2mol/L.

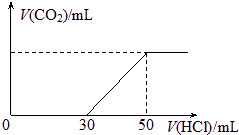 标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求:
标况下,在100 mL 0.1mol?L-1某NaOH溶液中通入一定量CO2后,再向所得溶液中滴加某浓度的稀盐酸,滴加盐酸的体积与生成气体的情况如图所示.(假设生成的CO2全部逸出).求:

 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( ) 已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.
已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.