
【题目】以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
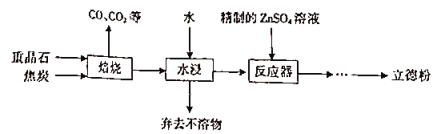
(1)焙烧(温度为1000~2000)时,焦炭需过量,其目的是____________________。
(2)焙烧过程中发生的反应之一是4CO+BaSO4![]() BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
BaS+4CO2,该反应的氧化剂与还原剂的物质的量之比为_________________,还原产物是___________。
(3)反应器中发生反应的化学方程式为______________________。
(4)流程中所需的精制的ZnsO,溶液的制取方法是:首先用工业级氧化锌(含少量FeO和Fe2O3杂质)和稀硫酸反应制取粗硫酸锌溶液,然后向粗硫酸锌溶液中先后加入H2O2溶液和碳酸锌精制。
①加入H2O2溶液时发生反应的离子方程式为______________________。
②加入碳酸锌的目的是________________,反应的化学方程式为_____________________。
【答案】焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加焦炭可以提高重晶石的利用率 1:4 BaS BaS+ZnSO4=BaSO4↓+ZnS↓ 2Fe2++H2O2+2H+=2Fe3++2H2O 先加入H2O2溶液,将亚铁离子氧化成铁离子,反应的离子方程式为,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素 Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑
【解析】
根据工艺流程可知,重晶石矿的主要成分为硫酸钡,在高温时与焦炭反应生成硫化钡和气体为CO、CO2等,所得固体再用水浸,硫化钡是可溶于水的盐,所以通过溶解过滤除去杂质,得硫化钡溶液,硫化钡溶液中加入精制的硫酸锌可得ZnS和BaSO4的混合物,
(1)硫酸钡与碳反应需要高温,焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加一种反应物可以提高另一种反应的转化率;
(2)化合价升高失去电子被氧化作氧化剂,化合价降低得到电子被还原作氧化剂;
(3)反应器中硫化钡与硫酸锌反应生成难溶的硫酸钡和硫化锌;
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,可以先加入H2O2溶液,将亚铁离子氧化成铁离子,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素,根据元素守恒和电荷守恒可书写离子方程式和化学方程式。
根据工艺流程可知,重晶石矿的主要成分为硫酸钡,在高温时与焦炭反应生成硫化钡和气体为CO、CO2等,所得固体再用水浸,硫化钡是可溶于水的盐,所以通过溶解过滤除去杂质,得硫化钡溶液,硫化钡溶液中加入精制的硫酸锌可得ZnS和BaSO4的混合物,
(1)硫酸钡与碳反应需要高温,焦炭燃烧能放出大量的热,可以提供反应所需要的条件,同时增加焦炭可以提高重晶石的利用率;
(2)反应4CO(g)+BaSO4(s)![]() BaS(s)+4CO2(g)中CO中碳元素化合价由+2价升高为+4价被氧化为还原剂,BaSO4中硫元素化合价由+6价降为-2价被还原为氧化剂,BaS为还原产物,根据反应可知,氧化剂与还原剂的物质的量之比为1:4;还原产物是BaS;
BaS(s)+4CO2(g)中CO中碳元素化合价由+2价升高为+4价被氧化为还原剂,BaSO4中硫元素化合价由+6价降为-2价被还原为氧化剂,BaS为还原产物,根据反应可知,氧化剂与还原剂的物质的量之比为1:4;还原产物是BaS;
(3)反应器中硫化钡与硫酸锌反应生成难溶的硫酸钡和硫化锌,反应的化学方程式为BaS+ZnSO4=BaSO4↓+ZnS↓;
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,可以先加入H2O2溶液,将亚铁离子氧化成铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,再加碳酸锌调节溶液的pH值,使Fe3+转化为红褐色氢氧化铁沉淀而除去铁元素,反应的化学方程式为Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________;
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、_______________;
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为__________________,该反应中氧化产物是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试回答下列各题:
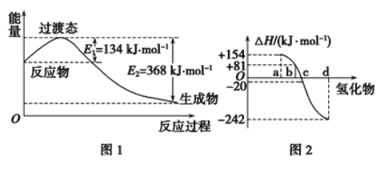
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)![]() 2HCl(g) ΔH=-185kJ·mol-1
2HCl(g) ΔH=-185kJ·mol-1
请填空:
共价键 | H-H | Cl-Cl | H-Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺(如图所示)是目前“海水提溴”的最主要方法之一。下列说法错误的是
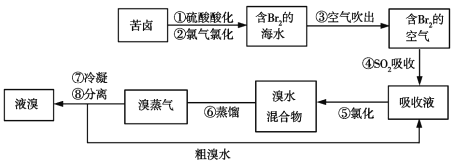
A. 步骤④、⑤是为了富集溴 B. 步骤③说明溴具有挥发性
C. 步骤④过程中,溶液的pH不断增大 D. 步骤⑧中的混合物可用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。下列关于螺[4,4]王烷(![]() )的说法错误的是
)的说法错误的是
A. 与环壬烯互为同分异构体 B. 二氯代物有12种(不含立体异构)
C. 所有碳原子不可能都处于同一平面 D. 螺环烷的分子式通式为CnH2n-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用电子式表示氯化氢分子的形成过程:![]()
B. 二氧化硅熔点高于二氧化碳是因为其分子间作用力更大
C. 吸热反应一定要加热才能发生
D. 需要加热才能发生的反应不一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:

已知:
室温下,①2NO+Na2O2===2NaNO2
②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是________________________________________。
(2)装置B中观察到的主要现象为________________________________________,发生反应离子方程式是_____________。
(3)装置D的作用是______________________________,发生反应的离子方程式是________________________________________。
(4)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和__________(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为__________(写名称)。
(5)利用改进后的装置将3.12gNa2O2完全转化为NaNO2,理论上至少需要木炭__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
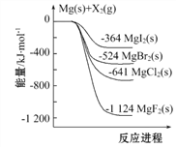
A. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
B. 热稳定性:MgI2 >MgBr2 >MgCl2 >MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g)△H=+117kJ·mol-1
MgCl2(s)+Br2(g)△H=+117kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com