
分析 (1)依据△G=△H-T△S计算判断,若△G<0,反应自发进行,若△G>0,反应非自发进行;
(2)在25℃下,将amol/L的氨水与0.005mol/L的硫酸等体积混合,反应平衡时溶液呈中性,c(H+)=c(OH-),平衡时溶液中c(NH4+)=2c(SO42-)=0.01mol/L,根据物料守恒得c(NH3.H2O)=(a-0.01)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$;
(3)已知c(MgCl2)=0.1mol•L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,可根据Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)计算c(OH-),然后根据Kw=1.0×10-14计算.
解答 解:(1)已知:在298K、100kPa下该反应的△H=-113.0kJ•mol-1,△S=-145.3J•mol-1•K-1,△G=△H-T△S=-113.0 kJ•mol-1-298 K×(-145.3 J•mol-1•K-1)×10-3≈-69.7 kJ•mol-1<0,反应自发进行,
故答案为:能;
(2)在25℃下,将amol/L的氨水与0.005mol/L的硫酸等体积混合,反应平衡时溶液呈中性,c(H+)=c(OH-),平衡时溶液中c(NH4+)=2c(SO42-)=0.01mol/L,根据物料守恒得c(NH3.H2O)=(a-0.01)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{(a-0.01)×1{0}^{-7}}{0.01}$=(a-0.01)×10-5,
故答案为:(a-0.01)×10-5;
(3)已知c(MgCl2)=0.1mol•L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,即Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-),故c(OH-)=$\sqrt{\frac{Ksp[Mg(OH)_{2}]}{c(M{g}^{2+})}}$=$\sqrt{\frac{4×1{0}^{-11}}{0.1}}$=2×10-5,Kw=1.0×10-14,故c(H+)=$\frac{1.0×1{0}^{-14}}{2×1{0}^{-5}}$=$\frac{1}{2}$×10-9,pH=9.3,
故答案为:9.3.
点评 本题考查了反应能否自发进行的熵判据,混合溶液pH值的计算,平衡常数的计算等知识点,本题题目难度中等,


科目:高中化学 来源: 题型:选择题
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目相同 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 食盐可作调味剂,也可以用作食品防腐剂 | |
| B. | 碳酸钾有一定的去污能力,在热水中去污能力会减弱 | |
| C. | 煤经过气化和液化等变化后,可以减少PM2.5引起的污染 | |
| D. | 根据纤维燃烧产生的气味,不能确定是否为蛋白质纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
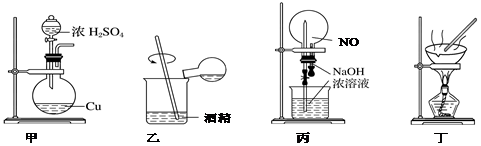
| A. | 用图甲做铜与浓硫酸反应制取SO2 | |
| B. | 用图乙配制浓硫酸与酒精的混合液 | |
| C. | 用图丙做NO与NaOH溶液的“喷泉”实验 | |
| D. | 用装置丁做蒸发CuCl2溶液获得CuCl2•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
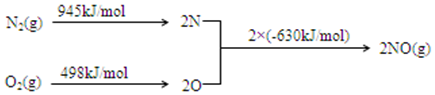
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com