
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
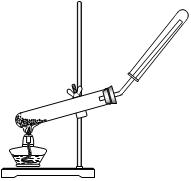
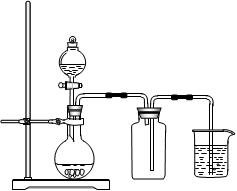
| A.用氯化铵和氢氧化钙制NH3 | B.用铜片和稀硝酸制NO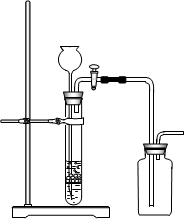 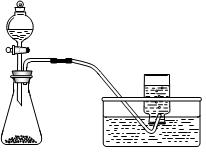 |
| C.用锌粒和稀硫酸制H2 | D.用双氧水和二氧化锰制O2 |
查看答案和解析>>
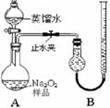
科目:高中化学 来源:不详 题型:实验题
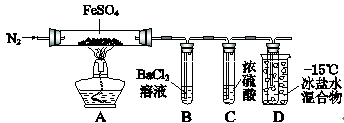
| | 实验过程 | 实验现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
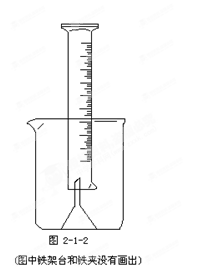
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
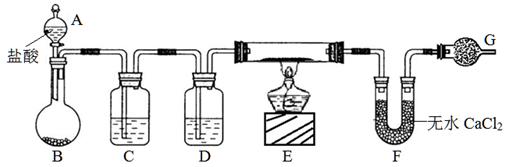
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
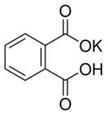
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
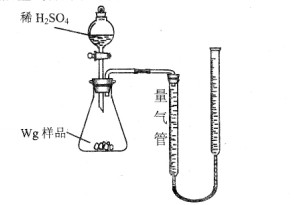
| A.盐酸 | B.KSCN溶液 | C.酸性KMnO4溶液 | D.H2O2溶液 |
| 序号 | 溶液中可能存在 的金属离子 | 选择最少种数的试剂,验证该 假设(填字母) |
| ① | | |
| ② | | |
| ③ | | |
 (Fe) (b-a)×10-3L
(Fe) (b-a)×10-3L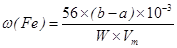
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
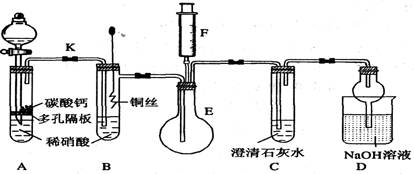
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com