
| A. | CO2的电子式为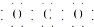 | B. | Cl-的结构示意图为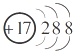 | ||
| C. | NaCl的电子式为Na+Cl- | D. | HCl的电子式为HCl |
分析 A.二氧化碳分子中含有两个碳氧双键;
B.氯离子的核电荷数为17,核外电子总数为18,最外层满足8电子稳定结构;
C.氯化钠为离子化合物,氯离子需要标出最外层电子;
D.氯化氢为共价化合物,电子式中需要标出最外层电子.
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故A错误;
,故A错误;
B.Cl-的最外层达到8电子稳定结构,其结构示意图为: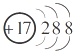 ,故B正确;
,故B正确;
C.氯化钠为离子化合物,钠离子之间用离子符号表示,氯离子需要标出所带电荷及最外层电子,氯化钠正确的电子式为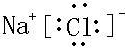 ,故C错误;
,故C错误;
D.HCl为共价化合物,电子式中需要标出最外层电子,氯化氢正确的电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)+2H2O(l);△H=-484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
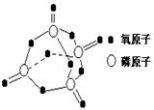 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3与Al(OH)3都能够作为治疗胃酸过多的药品 | |
| B. | 可以用铝制器皿盛放浓硫酸和浓氢氧化钠溶液 | |
| C. | 医院里用高锰酸钾溶液和双氧水来消毒,是因为两者有某种共同的性质 | |
| D. | 在水中投入适量的氢氧化钠固体可以增大明矾的净水效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
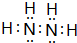
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com