
【题目】聚合氯化铝晶体是介于AlCl3和Al(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产工艺流程如下:

(1)操作1的操作是_________;
(2)升高pH至4.0~4.5的目的是_______________ ;
(3)生产过程中可回收使用的物质是__________(写物质名称);
(4)为使得到的晶体较纯净,生产过程中使pH升高的c物质可选用______(填编号);
a.NaOH b.Al c.氨水 d.A12O3 e.NaAlO2
(5)通过该法得到一种化学式为[Al2(OH)2Cl45H2O]10的(M=320 g/mol)聚合氯化铝晶体,为测定产品纯度,进行如下操作:
①称取1.600g样品,用适量盐酸溶解后配成100.00 mL溶液;
②取25.00 mL溶液,控制pH=3.5,加入过量0.1 mol/L 40 mL EDTA(Na2H2Y2H2O)标准液滴定(Al3+ + H2Y2 = AlY + 2H+),加热煮沸5~10分钟,使Al3+与EDTA结合稳定(EDTA与Al3+结合无色);
③待上一步结束后,调节溶液pH至5~6,加入二甲酚橙作指示剂,用0.1 mol/L标准Zn2+溶液滴定多余的EDTA(Zn2+ + H2Y2 = ZnY2 + 2H+),消耗标准液20.00 mL(已知:二甲酚橙与Zn2+形成的配合物是红紫色的溶液)滴定终点的现象是_________________;产品的纯度为____________。
【答案】 过滤 促进Al3+水解,使聚合氯化铝晶体析出 盐酸 b,d 溶液恰好变为浅红紫色 80%
【解析】(1)氧化铝与盐酸反应生成氯化铝和水,铝与盐酸反应生成氯化铝与氢气,二氧化硅与盐酸不反应,过滤即可实现分离;(2)由于最终得到聚合氯化铝晶体,所以升高pH至4.0~4.5的目的是促进Al3+水解,使聚合氯化铝晶体析出;(3)95℃加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到盐酸,可循环使用;(4)用氢氧化钠、偏铝酸钠和氨水调节pH值,会引入新的杂质:钠离子和铵根离子,所以可以加入Al和氧化铝进行处理,二者是固体,多了可以过滤掉,从而可以使得到的晶体较纯净,答案选bd;(5)已知:二甲酚橙与Zn2+形成的配合物是红紫色的溶液,所以滴定终点的现象是溶液恰好变为浅红紫色,且半分钟内不褪色;根据方程式可知过量的EDTA是0.002mol,则与铝离子反应的EDTA是0.004mol-0.002mol=0.002mol,所以25mL溶液中铝离子的物质的量是0.002mol,则原溶液中铝离子的物质的量是0.008mol,根据铝原子守恒可知产品的物质的量是0.004mol,质量是0.004mol×320g/mol=1.28g,所以产品的纯度为1.28g/1.60g×100%=80%。


科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是
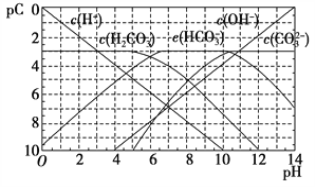
A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子数目的对应关系,完全正确的是( )
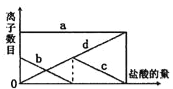
A. a:K+; b:HCO3—;c:CO32—;d:Cl—
B. a:K+; b:CO32—;c:HCO3—;d:Cl—
C. a:K+; b:CO32—;c:Cl—;d:HCO3—
D. a:K+; b:HCO3—;c:Cl—;d:CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:烧碱、纯碱、苛性钾、氢氧化钡
C. 混合物:盐酸、漂白粉、水煤气、氢氧化铁胶体
D. 碱性氧化物:Na2O、CaO、MgO、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式为
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是
A. 放电时负极反应式为Zn+2OH--2e- = Zn(OH)2
B. 放电时正极反应式为 FeO42-+4H2O+3e-= Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 充电时阳极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
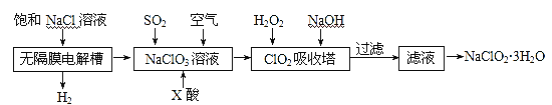
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成H2和NaClO3,请写出阳极的电极反应式_______________________________________________。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为_________。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为_________________________。
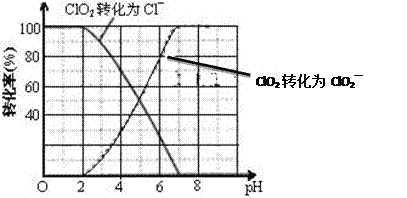
(4)ClO2被S2还原为ClO2、Cl转化率与pH关系如图。pH≤ 2时,1mol S2-转移2mol e-,写出ClO2与S2反应的离子方程式:__________________________________。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN等有明显的去除效果。某工厂污水中含CN a mg/L,现用ClO2将CN氧化,生成了两种无毒无害的气体,其离子反应方程式为_______________________;处理100 m3这种污水,至少需要ClO2 _____________ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极实现下列电解实验,其说法正确的是
A. 电解稀硫酸溶液,实质上是电解水,故溶液的c(H+)不变
B. 电解稀氢氧化钠溶液,阳极消耗OH-,故溶液的碱性减弱
C. 电解硫酸钠溶液,阴极和阳极析出产物的物质的量之比为2:1
D. 电解氯化铜溶液一段时间后,向溶液中加入适量的CuO可使电解液恢复到起始状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com