
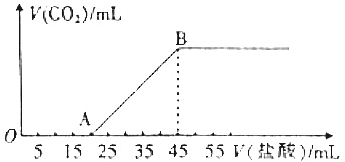
分析 (1)Na2CO3和NaHCO3组成的混合物中加入盐酸,先发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,然后碳酸氢钠与盐酸反应生成二氧化碳气体;
(2)结合图象可知,当加入35mL盐酸时,20~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体;
(3)根据OA段的反应及消耗盐酸的量计算出碳酸钠的物质的量,再根据总质量计算出碳酸氢钠的物质的量,最后计算出二者的物质的量之比.
解答 解:(1)加入盐酸后碳酸钠先与盐酸反应生成碳酸氢钠:Na2CO3+HCl═NaHCO3+NaCl,所以OA段的离子反应方程式为:CO32-+H+═HCO3-,
故答案为:CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-20)×10-3L×2mol•L-1=0.03mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.03mol n
故n=0.03mol,标准状况下其体积为0.03mol×22.4L/mol=0.672L,
故答案为:0.672L;
(3)设碳酸钠、碳酸氢钠物质的量分别为x、y,则
根据OA段的反应Na2CO3+HCl═NaHCO3+NaCl可知碳酸钠的物质的量为:x=2mol/L×0.02L=0.04mol,
根据总质量可得:84g/mol•y+106g/mol×0.04mol=5.08g,解得:y=0.01mol,
故原混会物中Na2CO3和NaHCO3的物质的量之比为0.04mol:0.01mol=4:1,
故答案为:4:1.
点评 本题考查混合物反应的计算,题目难度中等,明确反应的先后顺序及图象中每段图象对应的化学反应是解答本题的关键,试题培养了学生的分析能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,Y
,Y .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.
色沉淀,其作用是检验溴离子;装置(Ⅱ)还可起到的作用是防倒吸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发 | |
| B. | 常将钠保存在煤油中 | |
| C. | 新制氯水应密封保存在棕色试剂瓶中 | |
| D. | 取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com