
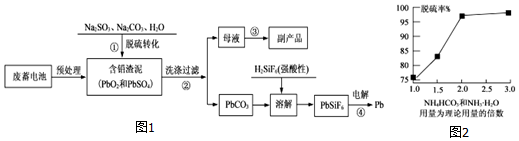
分析 将废蓄电池预处理,然后向含铅渣泥中加入Na2SO3、Na2CO3和H2O,Na2SO3和PbO2发生氧化还原反应生成PbSO4,PbSO4和Na2CO3反应转化为PbCO3,过滤、洗涤沉淀得到PbCO3,母液中含有Na2SO4,所以可以得到副产品Na2SO4;将PbCO3溶于强酸性H2SiF6中,得到PbSiF6,然后采用电解的方法制取Pb,
(1)铅蓄电池中Pb作负极,失去电子生成硫酸铅,据此判断即可;
(2)步骤①加入Na2SO3和PbO2发生氧化还原反应生成PbSO4;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净;
(4)根据图象不难看出NH4HCO3和NH3•H2O用量为理论用量的2.0倍时脱硫效率很高;(NH4)2SO4是可溶性盐,会留在母液中;
(5)粗铅精炼则阳极为粗铅,阴极为精铅,电解质溶液为含二价铅离子的溶液.
解答 解:(1)铅蓄电池中Pb作负极,由于电解质溶液是硫酸,硫酸铅难溶于水,故电极反应方程式为:Pb-2e-+SO42-=PbSO4,随着反应的进行,电极质量增大,
故答案为:Pb-2e-+SO42-=PbSO4;增大
(2)步骤①加入Na2SO3和PbO2发生氧化还原反应生成PbSO4,所以步骤①中加入Na2SO3的作用是作为还原剂将PbO2还原,故答案为:作为还原剂将PbO2还原;
(3)如果洗涤液中不含有硫酸根离子就证明洗涤干净,其检验方法为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净,故答案为:取少量最后一次洗涤液于试管中,滴入过量盐酸再滴入少量氯化钡溶液,如果无沉淀产生,证明已经洗涤干净;
(4)根据图象不难看出NH4HCO3和NH3•H2O用量为理论用量的2.0倍时脱硫效率很高;而这时(NH4)2SO4是可溶性盐,所以会留在母液中,故答案为:2.0;(NH4)2SO4;
(5)粗铅精炼则阳极为粗铅,阴极为精铅,电解质溶液为含二价铅离子的溶液,所以阴极的电极反应式为Pb2++2e-=Pb;
故答案为:粗铅;Pb2++2e-=Pb.
点评 本题考查较综合,涉及混合物的分离和提纯、电解原理、离子检验等知识点,能从整体上分析、把握制取原理,知道亚硫酸盐和二氧化铅能发生氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: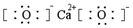 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2Ag+═Cu2++2Ag Cu+2AgCl═CuCl2+2 Ag | |
| B. | CO32-+2 H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Al3++3OH-═Al(OH)3↓ Al( NO3)3+3NH3•H2O═Al(OH)3↓+3NH4NO3 | |
| D. | H++OH-═H2O Ba(OH)2+2HNO3═Ba(NO3)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.
Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com