
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是___。
(3)若A容器和B容器的体积比为3∶2,则气体O2和气体O3质量之比为___,密度之比为____。
【答案】1:1 3:2 1:1 2:3
【解析】
A容器中氧气的摩尔质量为32g/mol,B容器中臭氧的摩尔质量为48g/mol,利用阿伏伽德罗定律及其推论进行分析;
(1)同温同压同分子数,依据阿伏伽德罗定律可知同体积;
(2)根据原子数相等可知物质的量之间的关系,利用体积之比等于物质的量之比进行计算;
(3)同温同压下,体积之比等于物质的量之比,再利用![]() 计算质量之比,结合密度公式可知密度之比。
计算质量之比,结合密度公式可知密度之比。
(1)同温同压同分子数,依据阿伏伽德罗定律可知同体积,即体积之比为分子数之比,是1:1;
(2)由于两容器中所含原子总数相等,可知分子数之比即物质的量之比是3:2,而同温同压下体积之比等于物质的量之比,可得体积比为3:2;
(3)同温同压下,体积之比等于物质的量之比,A容器和B容器的体积比为3∶2,即![]() ,又
,又![]() ,得
,得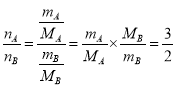 ,MA=32g/mol ,MB=48g/mol,那么有
,MA=32g/mol ,MB=48g/mol,那么有![]() ,即质量比为1:1;同温同压下,密度之比等于摩尔质量之比,则
,即质量比为1:1;同温同压下,密度之比等于摩尔质量之比,则![]() ,即密度之比为2:3。
,即密度之比为2:3。


科目:高中化学 来源: 题型:
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
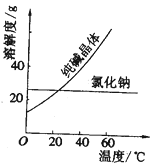
(2)阅读、分析下列两个材料:
材料一、(见图)
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于非氧化还原反应的是
A. 2Na + Cl2 === 2NaCl B. MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
C. 2KI+Cl2===2KCl+I2 D. MgO+2HCl===MgCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 =NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D. NaHSO4在水中的电离:NaHSO4 = Na+ + NaHSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l);ΔH=-285.8kJ·mol-1
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g);ΔH=+283.0 kJ/mol
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,不正确的是
A. 二氧化锰与浓盐酸加热反应:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 氯化镁溶液与氨水反应:Mg2++2NH3·H2O=Mg(OH)2↓+2NH
C. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-=Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,X 的质子数是 W 与 Z 的质子数之和的一半。m、n、p 是由这些元素组成的二元化合物,r 是元素 Y 的气体单质,n 为淡黄色粉末, 相关物质转化关系如图所示。室温下,0.01mol/L s 溶液 pH 为 12。下列说法误错的是
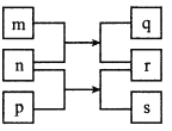
A.Z 是所在周期中原子半径最大的元素
B.简单离子半径大小:Y﹥Z﹥W
C.电负性:Y﹥X﹥W
D.n 中阴阳离子个数比为 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如图所示。下列说法不正确的是
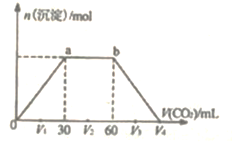
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. oa过程是CO2与Ba(OH)2反应生成BaCO3的过程
D. 原混合物中 n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com