
| A. | 乙醇、戊烷、硝基苯 | B. | 苯、四氯化碳、己烯 | ||
| C. | 苯、甲苯、环己烷 | D. | 甲醇、乙酸乙酯、乙酸 |
分析 A.乙醇与水混溶,戊烷、硝基苯不溶于水,但密度不同;
B.己烯使溴水褪色,苯、四氯化碳与溴水会分层,但是密度不同;
C.苯、甲苯、环己烷性质稳定,不溶于水;
D.甲醇与饱和碳酸钠溶液互溶,乙酸乙酯难溶于碳酸钠溶液,乙酸与碳酸钠反应生成气体.
解答 解:A.乙醇与水混溶,戊烷、硝基苯不溶于水,戊烷的密度比水小,硝基苯的密度比水大,可用水鉴别,故A不选;
B.己烯使溴水褪色,苯、四氯化碳与溴水会分层,但是密度不同,所以可以用溴水鉴别,故B不选;
C.苯、甲苯、环己烷性质稳定,不溶于水,只用一种试剂无法鉴别,故C选;
D.甲醇与饱和碳酸钠溶液互溶,乙酸乙酯难溶于碳酸钠溶液,乙酸与碳酸钠反应生成气体,所以可加饱和碳酸钠溶液鉴别,故D不选.
故选C.
点评 本题考查有机物的鉴别,题目难度不大,注意把握有机物性质的异同,为解答该题的关键点,学习中要注重相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,KI被氧化,CuI是还原产物 | |
| B. | 通入SO2后,溶液变无色,体现SO2的还原性 | |
| C. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| D. | 整个过程发生了复分解反应和氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
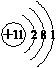 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
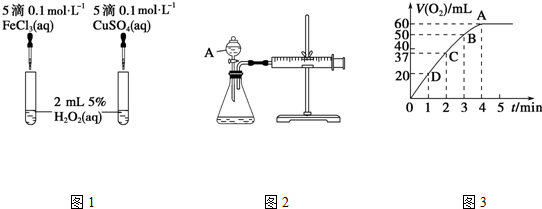
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
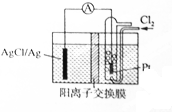 某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )
某原电池装置如图所示,电池总反应为2Ag+Cl2═2AgCl,电解液为1mol•L-1的盐酸.下列说法正确的是( )| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 放电时交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 放电后交换膜溶液酸性增强 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=3v逆(H2) | B. | v正(N2)=3v正(H2) | C. | 2v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(NH3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com