
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
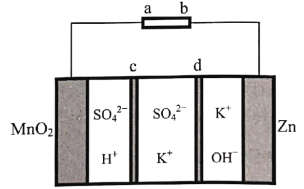
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
【答案】D
【解析】
根据电池放电总反应Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O,放电时,Zn失电子,作负极,电极反应式为:Zn-2e-+4OH-= Zn(OH)
+Mn2++2H2O,放电时,Zn失电子,作负极,电极反应式为:Zn-2e-+4OH-= Zn(OH)![]() ,MnO2得电子,作正极,电极反应式为:MnO2+4H++2e-=+Mn2++2H2O。
,MnO2得电子,作正极,电极反应式为:MnO2+4H++2e-=+Mn2++2H2O。
A. 放电时,Zn失电子,作负极,充电时,Zn电极区为阴极区,A正确;
B. 放电时,负极消耗OH-,K+通过阳离子交换膜d向左移动,正极消耗H+,![]() 通过阴离子交换膜c向右移动,B正确;
通过阴离子交换膜c向右移动,B正确;
C. 放电时,MnO2得电子,作正极,正极电极反应式为:MnO2+4H++2e-=+Mn2++2H2O,C正确;
D. 充电时,电子不能通过电解质溶液,D错误;故答案为:D。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.14gCO、N2混合气体中共含有7NA个电子
B.常温下,0.1mol环氧乙烷(![]() )共有0.3NA个共价键
)共有0.3NA个共价键
C.在含CO![]() 总数为NA的Na2CO3溶液中,Na+总数为2NA
总数为NA的Na2CO3溶液中,Na+总数为2NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在无氧条件下,葡萄糖发生反应C6H12O6![]() 2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
2CH3CH2OH + 2CO2↑。设NA是阿伏伽德罗常数的值。下列说法正确的是
A.0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA
B.常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA
C.4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA
D.2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
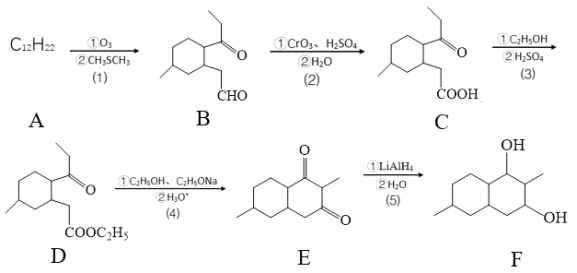
【题目】下列有关化学合物(F)的合成路线如下:
已知: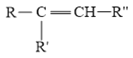
![]()
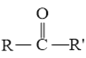 +R″-CHO
+R″-CHO
回答下列问题:
(1)化合物D官能团的名称是_________________。
(2)反应⑸的反应类型是____________。
(3)化合物A的键线式是____________。
(4)化合物B与新制的Cu(OH)2悬浊液反应的化学方程:____________。
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有____个。
(6)芳香化合物G是化合物E的同分异构体,且G满足以下两个条件:
①1molG与足量金属钾反应,在标准状况下放出22.4LH2;
②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1。
则G可能的结构简式____________。
⑺设计由![]() 制备
制备 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图:
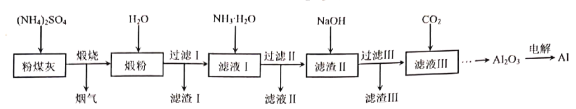
回答下列问题:
(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为___。
(2)“滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为__、__。
(3)将“滤液Ⅱ”通过__、过滤、洗涤、干燥后得到的晶体可返回__工序中循环利用。
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为__。
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为__。
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,则原粉煤灰中铝的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如图所示,符合如图所示的情况是( )
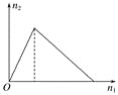
A.X为氢氧化钠,Y为氯化铝
B.X为氯化铝,Y为氢氧化钠
C.X为盐酸,Y为偏铝酸钠
D.X为偏铝酸钠,Y为盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白:
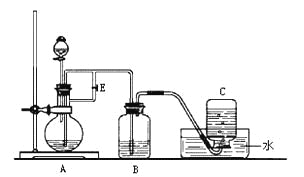
(1)B中盛有一定量的______________,A中应预先加入的试剂是_________,
A中反应的化学方程式为________________________________________。
(2)实验开始时应先将活塞E_______(填“打开”或“关闭”),目的是______________________________________________________________________________。
(3)A反应一段时间后将活塞E_______(填“打开”或“关闭”),目的是____________________________________________________________________________。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为____________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_________(写化学式,下同)。写出“乙![]() 丙”转化的离子方程式:______________________。
丙”转化的离子方程式:______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________。写出“甲![]() 乙”转化的离子方程式:_________________。
乙”转化的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
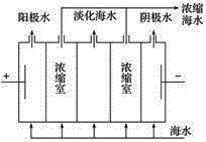
A.海水提溴的过程中,没有发生氧化还原反应
B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同
C.从海水中可以得到NaCl,电解NaCl溶液可制备金属钠
D.如图,在电场中利用膜技术(阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)淡化海水,此法称为电渗析法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com