
| A、O2-ls22s22p6 |
| B、S2-ls22s22p6 3s23p44s2 |
C、F  |
D、Na+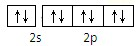 |
 ,故C正确;
,故C正确; ,故D正确,
,故D正确,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+ |
| B、AlO2- |
| C、Al3+ |
| D、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2和D2互为同位素 | ||||||
| B、CH3-CH2-OH与CH3-O-CH3互为同分异构体 | ||||||
| C、正丁烷和异丁烷是同素异形体 | ||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5CH═CHCH(CH3)-CH═CHC2H5 |
B、 |
| C、HCOOH |
| D、C6H5CH(CH3)CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、若剩余固体只为一种,则原混合物中
| ||
B、若剩余气体在标准状况下的相对分子质量为38,则原混合物中
| ||
C、若剩余气体只有一种,则原混合物中
| ||
D、若取16.2g剩余固体用盐酸溶解,当消耗0.3mol溶质时,恰好反应完且溶液呈中性,则原混合物中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
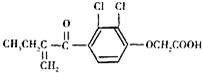 我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )
我国崇尚体育公平,倡导绿色奥运,而运动员服用兴奋剂事件有时有发生,图是兴奋剂利尿酸的结构.关于它的说法不正确的是( )| A、利尿酸的分子式为:C13H12O4Cl2 |
| B、1mol利尿酸最多可与5mol H2发生反应 |
| C、利尿酸所有碳原子可能共面 |
| D、利尿酸在一定条件下能发生消去、氧化、还原、水解、银镜等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积等浓度的两种弱酸盐NaA、NaB溶液中,离子总数一定相等 |
| B、等物质的量浓度的氯化钠和醋酸钠混合溶液中,微粒关系有c(Na+)=c(Cl-)+c(CH3COO-) |
| C、在NaHSO3溶液微粒由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3) |
| D、若弱酸的酸性H2A>H2B,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com