
 ��ѧ�����ͨѸ����ͨ���ճ����������Ź㷺��Ӧ�ã�
��ѧ�����ͨѸ����ͨ���ճ����������Ź㷺��Ӧ�ã�| 360000g |
| 18g/mol |
| 20000mol��4mol |
| 2mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������ԭ��Ӧ |
| B��������ԭ��Ӧ |
| C�����ȷ�Ӧ |
| D�����ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��N2O |
| B��NO |
| C��N2O3 |
| D��NO2 |
�鿴�𰸺ͽ���>>
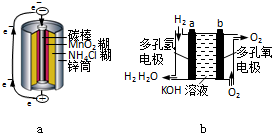
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ��ʾ��ԭ���װ�ã�
��ͼ��ʾ��ԭ���װ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72-ת��ΪCr��OH��3������ȥ�����ֽ����������ɳ�����pH�����
�����ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72-ת��ΪCr��OH��3������ȥ�����ֽ����������ɳ�����pH�����| ��ʼ������pH | ��ȫ������pH | |
| Fe��OH��2 | 7.0 | 9.0 |
| Fe��OH��3 | 1.9 | 3.2 |
| Cr��OH��3 | 6.0 | 8.0 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
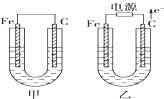 �밴Ҫ��������и�����գ�
�밴Ҫ��������и�����գ�| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ȥCl2�е�HCl |
B��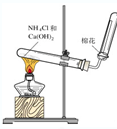 ʵ�����ư��� |
C��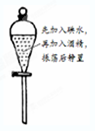 ��ȡ��ˮ�е� |
D��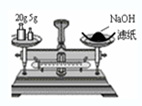 �����������ƹ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com