
分析 (1)n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,硝酸过量,Cu完全反应,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=$\frac{0.05mol}{1L}$=0.05mol/L,结合电荷守恒可计算稀释后溶液的c(H+);
(2)结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量.
解答 解:(1)n(Cu)=$\frac{3.2g}{64g/mol}$=0.05mol,硝酸过量,Cu完全反应,与硝酸反应生成Cu2+,加水稀释至1000mL,溶液中c(Cu2+)=$\frac{0.05mol}{1L}$=0.05mol/L,根据溶液的电荷守恒:2c(Cu2+)+c(H+)=c(NO3-),则c(H+)=0.2moL/L-2×0.05mol/L=0.1mol/L,
故答案为:0.1 mol/L;
(2)设n(NO2)=xmol,n(NO)=ymol,
根据电子守恒,有x+3y=0.05×2,
根据N元素守恒,有x+y=0.03a-0.2,
解之得:x=(0.045a-0.35)mol,y=(0.15-0.015a)mol;
故答案为:(0.045a-0.35)mol;(0.15-0.015a)mol.
点评 本题考查混合物计算、根据方程式计算,侧重于学生的分析能力和计算能力的考查,属于字母型计算,增大计算难度,为易错题目,注意利用守恒法计算解答,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 原子中均含22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 组成的金属钛单质互称同分异构体 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti 在周期表中位置相同,都在第四周期 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池总反应的离子方程式为:Mg+H2O2+2H+═Mg2++2H2O | |
| B. | 负极的电极反应为:H2O2+2H++2e-═2H2O | |
| C. | 工作时,正极周围海水的pH减小 | |
| D. | 电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
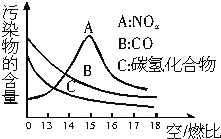 稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.
稀薄燃烧是指汽油在较大空/燃比(空气与燃油气的体积比)条件下的燃烧.随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的重视,但稀薄燃烧时,现用的汽油尾气净化装置不能有效地将NOx转化为N2.不同空/燃比时汽车尾气中主要污染物的含量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氧和液氢最好在临发射前的一段时间加注 | |
| B. | 氢气可由电解水获得 | |
| C. | 燃烧产物对发射环境没有污染 | |
| D. | 氢是一次能源,可以自己产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
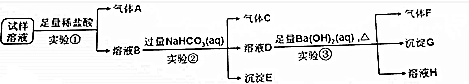
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com