
【题目】在氯化铵溶液中,下列关系式正确的是( )
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. c(NH4+)> c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)
D. c(NH4+)= c(Cl-)>c(H+)>c(OH-)
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A. 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA
B. 71g氯气通入足量的水中,反应中转移的电子总数为NA
C. 由D和18O所组成的水11g,所含的中子数为4NA
D. 1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙错误的是
A. 负极反应式为Mg-2e-=Mg2+
B. 正极反应式为Ag+e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 电池放电时,外电路中,电子由负极向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

已知:
① 2NO+Na2O2=2NaNO2。
② NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③ 在酸性条件下,NaNO2能将I-氧化为I2;S2O32-能将I2还原为I-。
④ 在此条件下,Na2O2完全反应,无剩余。
【制备NaNO2】
(1) 装置A的三颈烧瓶中发生反应的化学方程式为_____________。
(2) 装置B中水和铜的作用分别是__________、__________。
(3) 为了保证制得亚硝酸钠的纯度,装置C中盛放的试剂可能是_________(填字母)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.NaCl
(4) 装置E的作用是_______________。
【测定NaNO2纯度】
(5) 可供选择的试剂有:
A.稀硫酸 b.c1mol/LKI溶液 C.淀粉溶液 D.c2mol/LNa2S2O3溶液 e.c3 mol/L酸性KMnO4溶液
① 利用NaNO2的还原性来测定其纯度,可选择的试剂是________(填字母)。
② 利用NaNO2的氧化性来测定其纯度的步骤如下:
准确称取质量为m g的NaNO2样品,放入锥形瓶中,加入适量水溶解,_________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂作电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源进行饱和氣化钠溶液的电解实验,如图所示。
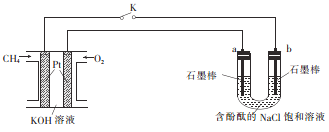
回答下列问题:
(1) a电极为____________(填“阳极”或“阴极”),b电极附近溶液的pH_________(填“增大”“减小”或“不变”)。
(2) 甲烷燃料电池正极的电极反应式为________________。
(3) 电解时b电极的电极反应式为__________;若反应生成0.2 mol Cl2,则消耗CH4的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存且溶液颜色为无色的是
A. Na+、MnO4-、K+、NO3-、SO32- B. Na+、S2-、SO32-、H+、、NO3-
C. Na+、S2-、OH-、K+、Cl- D. HCO3-、H+、Na+、Ca2+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com