
| A. | 1mol A+0.5mol B+1.5mol C+0.1mol D | |
| B. | 3mol C+0.5mol D | |
| C. | 2mol A+1mol B+1molD | |
| D. | 0.5mol A+0.25mol B+2.25mol C |
分析 反应2A(g)+B(g)?3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为1.2mol/L,说明与原平衡为完全等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol、n(B)=1mol即可,据此进行分析.
解答 解:在恒温恒容下,不同途径达到平衡后,C的浓度仍为1.2mol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,应该满足n(A)=2mol、n(B)=1mol.
A.开始投入1molA+1.5molB+1.5molC+0.1molD,按化学计量数转化到左边可得1.2molA、0.6molB,剩余1.2molC,与原平衡不是等效平衡,故A错误;
B.开始投入3mol C+0.5molD,按化学计量数转化到左边可得1molA、0.5molB,剩余1.5molC,与原平衡不是等效平衡,故B错误;
C.D为固体,不影响平衡移动,开始通入2mol A+1mol B+1molD,与原平衡为完全等效平衡,故C正确;
D.开始投入0.5mol A+0.25mol B+2.25mol C,与原反应n(A)=2mol、n(B)=1mol不相等,不是等效平衡,达到平衡时C的浓度为不是1.2mol/L,故D错误,
故选:C.
点评 本题考查等效平衡,难度中等,构建平衡建立的途径是解题关键,注意理解等效平衡规律,难度中等.


科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨水、水玻璃、漂白粉属于电解质 | |
| B. | Cl2、SO2均使品红溶液褪色,但原理不相同 | |
| C. | 同温同压下,相同体积的任何气体都含有相同的原子数 | |
| D. | Na2O2、FeO是碱性氧化物;NO2、SO3是酸性氧化物;Al2O3、SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | D. | HClO>Cl2>Cu2+>Fe3+>Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| B. | 当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | 当滴入20mL NaOH溶液时:2c(SO42-)═c(NH3•H2O)+c(NH4+) | |
| D. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•molˉ1 | |
| B. | 由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-57.3 kJ•molˉ1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
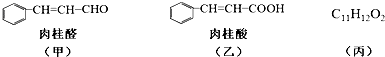
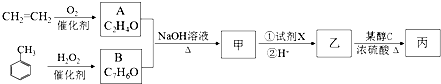
 .
. $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$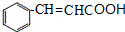 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.如表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| CO | CO2 |
| H2S | H2SO4 |
| Cl2 | HCl |
| N2O4 | NO |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-═2Cl- | |
| C. | 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+4e-═2O2- | |
| D. | 检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com