
【题目】下列说法正确的是
A. 甲苯( )与氯气在光照条件下反应主要生成2,4-二氯甲苯(
)与氯气在光照条件下反应主要生成2,4-二氯甲苯( )
)
B. 溴水可以用来区分直馏汽油和裂化汽油
C. 向淀粉水解后的溶液中依次加入过量氢氣化钠溶液、几滴碘液,溶液不变蓝则证明淀粉己完全水解
D. 按系统命名法,化合物 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____
(2)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理:_______________
(3)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________
(4)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1 的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
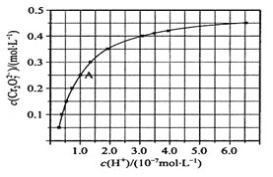
①由图可知,溶液酸性增大,CrO42的平衡转化率_________(填“增大“减小”或“不变”),
② 据A点数据,计算出该转化反应的平衡常数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水溶液中的电离方程式是:H2A=H++HA-;HA-![]() H++A2-,回答下列问题:
H++A2-,回答下列问题:
(1)Na2A溶液显___(填“酸性”、“中性”或“碱性”),理由是____(用离子方程式表示);NaHA溶液显____(填“酸性”、“中性”或“碱性”),理由是_____(用离子方程式表示)。
(2)若0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)________(填“>”、“=”或“<”)0.11 mol·L-1。
(3)0.1 mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是__________________。
(4)H2A溶液和Na2A溶液能否发生反应?若能反应请写出离子方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关物质制备的说法不正确的是( )
A.工业上电解饱和食盐水制取氯气、烧碱称为侯氏制碱法
B.工业上炼铁用CO做还原剂
C.工业上电解熔融的MgO制备金属镁
D.工业上用焦炭和二氧化硅高温下反应可制得粗硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中书写正确的是( )
A. NaHSO4![]() Na++H++SO42﹣ B. NaHCO3
Na++H++SO42﹣ B. NaHCO3![]() Na++H++CO32﹣
Na++H++CO32﹣
C. HClO=H++ClO﹣ D. MgCl2═Mg2++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)![]() 3Ca2+(aq)+2PO43﹣(aq)
3Ca2+(aq)+2PO43﹣(aq)
(1)溶度积Ksp=_________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 molL﹣1,c(PO43﹣)=1.58×10﹣6 molL﹣1,Ksp=___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以赤铁矿为原料,利用高炉炼铁的基本反应为:
i.Fe2O3(s)+3CO![]() 2Fe(s)+3CO2(g)△H1
2Fe(s)+3CO2(g)△H1
其中CO产生的反应是:
ii.C(焦炭,s)+O2(空气,g)=CO2(g)△H2<0
iii.C(焦炭,s)+CO2(g)=2CO(g)△H3>0
(1)以焦炭炼铁的反应:3C(焦炭,s)+2Fe2O3(s)![]() 4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
4Fe(s)+3CO2(g)的△H=____________(请用含△H1、△H2或H3的式子表示)。
(2)反应i的平衡常数与温度的关系如下表,请回答:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64.0 | 50.6 | 42.9 |
①当反应温度为1150℃,高炉中n(CO):n(CO2)=4:1时,v正_____v逆(填大于、小于、或等于)。
②己知高炉容积VL,反应温度1000℃。若提供给i反应的CO共2.24×103L(已折算标准状况),该反应经过tmin达平衡,则CO2在此段时间的反应速率为________(用V、t代数式表示)。
(3)T℃下,初始体积均为2L,初始压强均为100kPa的甲(固定体积),乙(固定压强)两容器中各充入2molCO进行反应iii,达平衡时甲中气体压强变为原来的4/5倍。请回答:
①下列可以判断甲中反应达平衡的是________________(填字母序号)。
a.2c(CO2)=c(CO)
b.v正(CO2)=2v逆(CO)
c.气体密度不再改变
d.气体平均分子量不再改变
②下图为甲、乙两容器中CO的百分含量(CO%)与时间(t)的关系示意图,其中代表乙容器的是___________(填字母编号),理由是______________________。

③乙容器中达平衡时的平衡常数Kp=___________________(Kp为用压强表达的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B发生反应:
3A(g)+2B(g)![]() 4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),5min后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 若向平衡体系中加入少量C,则正、逆反应速率均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com