
| A. | 常温下饱和氨水的pH<7 | |
| B. | 向氨水中滴加过量硫酸,所有平衡均向正向移动,pH增大 | |
| C. | 电离是吸热反应,升高温度,所有平衡均正向移动 | |
| D. | 向氨水中加入少量NaOH固体,所有平衡均逆向移动,有NH3放出 |
分析 A.NH3•H2O是弱碱;
B.硫酸电离的氢离子与氨水中的氢氧根离子结合生成水;
C.电离是吸热反应,升高温度,促进电离;
D.向氨水中加入少量NaOH固体,导致溶液中氢氧根离子浓度增大.
解答 解:A.NH3•H2O是弱碱,其水溶液显碱性,所以溶液的pH大于7,故A错误;
B.向氨水中滴加过量硫酸,硫酸电离的氢离子与氨水中的氢氧根离子结合生成水,溶液中氢氧根离子浓度减小,则pH减小,故B错误;
C.电离是吸热反应,升高温度,促进电离,升高温度氨气挥发,所以NH3+H2O?NH3•H2O的平衡向逆方向移动,故C错误;
D.向氨水中加入少量NaOH固体,导致溶液中氢氧根离子浓度增大,NH3+H2O?NH3•H2O?NH4++OH-的平衡逆向移动,会生成氨气,故D正确.
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,再结合溶液中离子浓度变化确定平衡移动方向,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:实验题
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
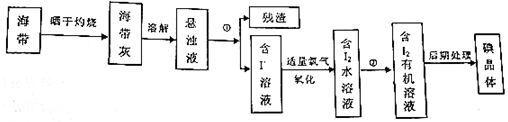
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品b于烧杯中,加足量蒸馏水,并用玻璃棒搅拌 | 样品溶解,形成无色溶液. |
| 步骤2:取少量步骤1形成的溶液于试管中,再滴加少量NaOH溶液,振荡 | 有白色沉淀生成,说明样品b中添加了镁盐 |
| 步骤3:取少量步骤1形成的溶液于试管中,再滴加少量的BaCl2溶液振荡 | 若有白色沉淀产生,则添加的是MgSO4.若无明显现象,则添加的是MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z3X与ZX3中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有单质均为无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com