
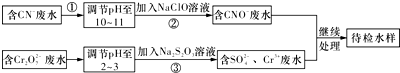
分析 由流程可知,CN-废水调整溶液pH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液pH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,处理的废水继续处理得到待测水样;
(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(2)Cr元素的化合价由+6价降低为+3价,结合化合价计算转移电子;
(3)Cr3+废水有毒,可使Cr3+生成沉淀过滤除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生沉淀的转化.
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-,
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol,故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去,
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,则氰化钠应该多些,故a>0.01;
由电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-)及pH=7,可知c(H+)=c(OH-)=10-7 mol•L-1,c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L,
再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L;Ka﹦$\frac{c({H}^{+}).c(C{N}^{-})}{c(HCN)}$=$\frac{1{0}^{-7}×(\frac{a}{2}-\frac{0.01}{2})}{\frac{0.01}{2}}$=(100a-1)×10-7 mol•L-1;
故答案为:>;(100a-1)×10-7 mol•L-1;
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,涉及的离子反应方程式为Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2++2OH-═Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
点评 本题以污水处理流程综合考查混合物分离提纯,为高频考点,题目综合性较强,涉及氧化还原反应、离子方程式、水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识,侧重考查学生的知识运用能力、灵活分析处理实际问题的能力,题目难度中等


科目:高中化学 来源: 题型:解答题
 ③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.
③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.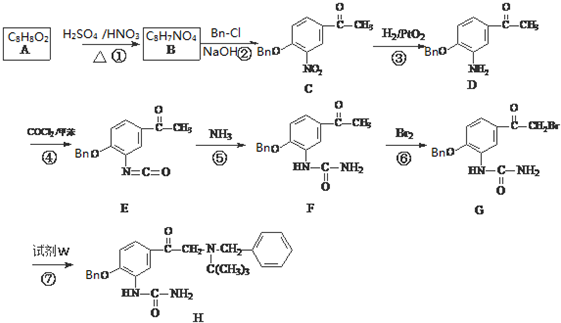
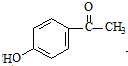 W
W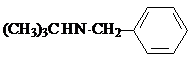 .
.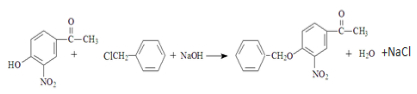 .
.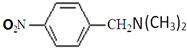 (无机试剂任用)
(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
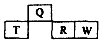 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
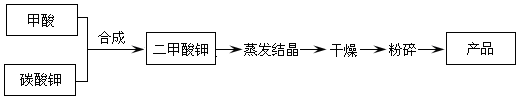
| 反应温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 产品回收率(%) | 75.6 | 78.4 | 80.6 | 82.6 | 83.1 | 82.1 | 73.7 |
| 反应物料比 | 2:1 | 3:1 | 4:1 | 5:1 | 6:1 | 7:1 |
| 产品回收率(%) | 0 | 38.4 | 82. 6 | 83.6 | 84.5 | 84.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
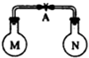 室温时,两个容积相同的烧瓶中分别盛有M和N 两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N 两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序是( )| 编号 | ① | ② | ③ | ④ |
| 气体M | H2S | H2 | NH3 | NO |
| 气体N | SO2 | Cl2 | HCl | O2 |
| A. | ②④①③ | B. | ①②③④ | C. | ④①②③ | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=2HClO+SO32- | |
| B. | 碳酸钙中滴入醋酸溶液:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O | |
| D. | 硫酸亚铁溶液中加过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
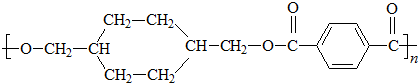
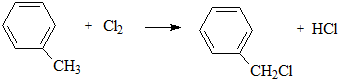
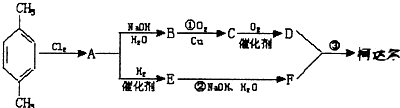
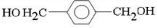 、D
、D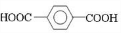 、E
、E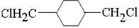 ;
;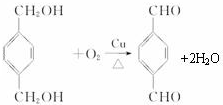
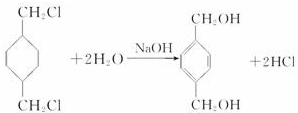 ;
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$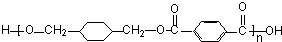 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
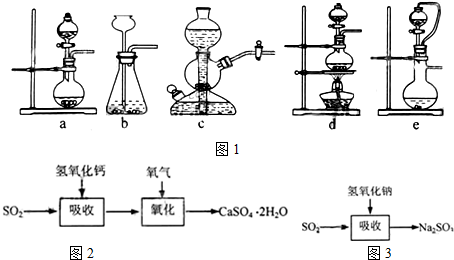
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com