
【题目】[化学﹣﹣选修物质结构与性质]下表为元素周期表的一部分.请回答下列问题: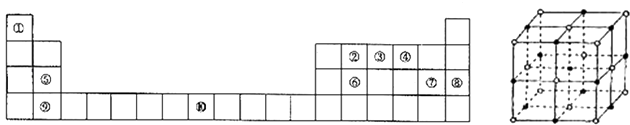
(1)上述元素中,属于s区的是(填元素符号).
(2)写出元素⑩的基态原子的电子排布式 .
(3)元素第一电离能为⑤⑨(填“大于”或“小于”).
(4)元素③气态氢化物的中心原子有对弧对电子,其VSEPR模型为;中心原子的杂化类型为;该分子为分子(填“极性”或“非极性”).向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为 .
(5)元素⑦的钠盐晶胞结构如图所示,每个Na+周围与之距离最近的Na+的个数为 . 若设该晶胞的棱长为a cm,阿伏伽德罗常数的值为NA , 则该钠盐的密度为 .
【答案】
(1)H、Mg、Ca
(2)1s22s22p63s23p63d64s2
(3)大于
(4)1,正四面体,sp3,极性,先产生蓝色沉淀,后溶解得深蓝色溶液
(5)12,![]()
【解析】(1)由图可知①⑤⑨处于s区,由①位于第一周期第ⅠA族,是氢元素;⑤位于第三周期第ⅡA族,是镁元素;
⑨位于第四周期第ⅡA族,是钙元素.
所以答案是:H、Mg、Ca.
(2)元素⑩为26号元素,是Fe,其基态原子的电子排布式1s22s22p63s23p63d64s2.
所以答案是:1s22s22p63s23p63d64s2.
(3)元素⑤与⑨处于同一主族,元素⑨核电荷数大,金属性更强,第一电离能小.
所以答案是:大于.
(4)元素③为N元素,其气态氢化物为NH3,中心原子有1对孤对电子,N原子价层电子对为4,其VSEPR模型为正四面体;
N原子的杂化轨道数为4,所以N原子采取sp3杂化;
NH3空间结构不对称,N元素化合价绝对值大于3,故NH3是极性分子;向硫酸铜溶液中逐滴加入氨水,先生成氢氧化铜蓝色沉淀,滴加过量氨水,氢氧化铜与NH3生成深蓝色四氨合铜络离子,沉淀溶解.
所以答案是:1;四面体;sp3;极性;先产生蓝色沉淀,后溶解得深蓝色溶液.
(5)元素⑦为氯元素,其钠盐为NaCl,在氯化钠晶胞中若以黑色球为钠离子,白色球为氯离子,以中心的黑色球钠离子分析,Na+周围与之距离最近的Na+处于对角线上,故有12个.
氯化钠晶胞中钠离子数为1+12× ![]() =4,氯离子数为8×
=4,氯离子数为8× ![]() +6×
+6× ![]() =4,所以含有的NaCl分子个数为4个,氯化钠晶胞质量为
=4,所以含有的NaCl分子个数为4个,氯化钠晶胞质量为 ![]() ,晶胞体积为a3cm3,所以氯化钠的密度为ρ=
,晶胞体积为a3cm3,所以氯化钠的密度为ρ= 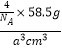 =
= ![]() .
.
所以答案是:12; ![]() .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是( )
A. 铁、四氧化三铁、冰水混合物 B. 金属钙、生石灰、碱石灰
C. 水银、空气、干冰 D. 二氧化硫、水蒸气、天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H2O(g)=H2(g)+ ![]() O2(g)△H=+241.8kJ/mol;H2(g)+
O2(g)△H=+241.8kJ/mol;H2(g)+ ![]() O2(g)=H2O(1)△H=﹣285.8kJ/mol当1g液态水变为水蒸气时,其热量变化是( )
O2(g)=H2O(1)△H=﹣285.8kJ/mol当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88Kj
B.吸热2.44KJ
C.放热44kJ
D.吸热44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D都是短周期元素,原子半径D>C>A>B,其中A,B处在同一周期,A,C处在同一主族.C原子核内质子数等于A,B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍.试回答:
(1)这四种元素分别是:A , B , C , D .
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是 .
(3)A与B形成的三原子分子的电子式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是 , 最活泼的非金属元素是;
(2)化学性质最不活泼的元素是 , 其原子的原子结构示意图为;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是 , 原子半径最小的是;
(5)在⑦与⑩的单质中,化学性质较活泼的是 , 可用什么化学反应说明该事实(写出反应的化学方程式): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为 . 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据VSEPR模型,PO43﹣的分子立体结构为:;乙醇易溶于水的原因是;HClO4的酸性强于HClO的原因是;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的 ![]() ,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
,写出该元素原子的电子排布式是 . 写出铬元素在周期表中的位置 , 它位于区.
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏伽德罗常数,则氯化铯晶体的密度为g/cm3 . 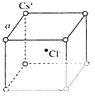
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色澄清溶液中Cl﹣浓度为0.5molL﹣1 , 还可能含有表中的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3﹣ CO32﹣ SiO32﹣ SO42﹣ OH﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子有 . 能确定一定不存在的离子是
(2)实验Ⅰ中生成沉淀的离子方程式为 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(molL﹣1) |
① | |
② | |
③ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
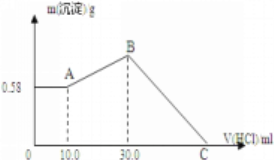
(1)混合物中各物质的物质的量:
NaOH是_______,AlCl3是________,MgCl2是________。
(2)C点所加的盐酸的体积是________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com