
若25℃时,CH3COOH的电离平衡常数Ka=1.8×10﹣5,则该温度下0.18mol/L的CH3COONa溶液的pH=9(CH3COONa水解程度很小,计算时可将CH3COO﹣的平衡浓度看成是CH3COONa溶液的浓度)
考点: pH的简单计算.
分析: 醋酸钠水解离子方程式为CH3COO﹣+H2O=CH3COOH+OH﹣,设溶液中c(OH﹣)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO﹣的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K=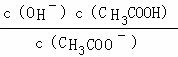 =
=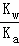 =
=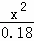 =
=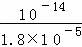 ,x=10﹣5,溶液中c(H+)=
,x=10﹣5,溶液中c(H+)=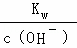 =
=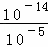 mol/L=10﹣9mol/L,pH=﹣lgc(H+).
mol/L=10﹣9mol/L,pH=﹣lgc(H+).
解答: 解:醋酸钠水解离子方程式为CH3COO﹣+H2O=CH3COOH+OH﹣,设溶液中c(OH﹣)=xmol/L,CH3COONa水解程度很小,计算时可将CH3COO﹣的平衡浓度看成是CH3COONa溶液的浓度,所以该溶液水解平衡常数K= =
= =
=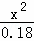 =
=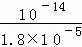 ,x=10﹣5,溶液中c(H+)=
,x=10﹣5,溶液中c(H+)=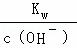 =
=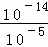 mol/L=10﹣9mol/L,pH=﹣lgc(H+)=﹣lg10﹣9=9,故答案为:9.
mol/L=10﹣9mol/L,pH=﹣lgc(H+)=﹣lg10﹣9=9,故答案为:9.
点评: 本题考查pH简单计算,侧重考查学生分析推断及计算能力,明确离子积常数与电离平衡常数、水解平衡常数关系是解本题关键,注意醋酸根离子及醋酸分子、氢氧根离子近似处理方法,题目难度中等.


科目:高中化学 来源: 题型:
(1)现有1mol/L CaCl2溶液0.5L,Cl﹣的物质的量浓度为 mol/L.
(2)标准状况下,33.6L的HCl所具有的物质的量为 mol,将其溶解于水配成3L的溶液,所得盐酸的物质的量浓度为 mol/L.
(3)8gNaOH溶于 g水中,才能使每10个水分子中溶有一个钠离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是()
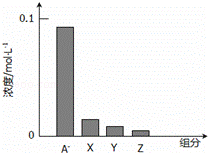
A. HA为强酸
B. 该混合液pH=7
C. 图中X表示HA,Y表示OH﹣,Z表示H+
D. 该混合溶液中:c(A﹣)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)⇌CH3OH(g)+H2O(g)△H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是()

A. P3>P2 T3>T2 B. P2>P4 T4>T2
C. P1>P3 T3>T1 D. P1>P4 T2>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的同位素 X,其氯化物XCl2 1.11g配成溶液后,需用1mol/L的AgNO3溶液20mL才能把氯离子完全沉淀下来.已知同位素中有20个中子.
X,其氯化物XCl2 1.11g配成溶液后,需用1mol/L的AgNO3溶液20mL才能把氯离子完全沉淀下来.已知同位素中有20个中子.
(1)计算X的质量数为多少?
(2)指出X元素在周期表中的位置.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是()
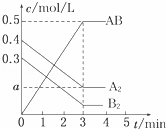
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com