
在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,
例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式
;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)= : : : .
科目:高中化学 来源:活题巧解巧练·高一化学(下) 题型:022
物质的组成可用不同形式表示.
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后,H2O一般写在后面).
①角闪石棉[Ca2Mg5(Si4O11)2(OH)2]________,
②钾云母[K2H4Al6Si6O24]________.
(2)某型号水泥的主要成分有:Ca2SiOx,Ca3SiOy,Ca3Al2Oz,则x=________,y=________,z=________.
(3)许多含氧酸及其盐类均可以类似硅酸盐形式改写成氧化物形式,请继续改写以下物质:HNO3________,HCOOH________.
通过以上改写可知,HNO3的酸性氧化物为________,HCOOH与浓硫酸反应可制取________气体.
(4)已知在一定条件下.Fe在Cl2中燃烧可以生成Fe3Cl8,它可以看做是FeCl2·2FeCl3,类似地碘与铁在一定条件下可得到Fe3I8,则它可看做是________.
查看答案和解析>>
科目:高中化学 来源:高三模拟考试化学试题(三) 题型:填空题
土壤是人类从事农业、林业生产的一项重要资源。保护土壤防止污染、合理利用土壤是我们每个人的职责。请回答问题。
(1)有人说,电动自行车的发展,可能是环保背后的更大污染。这一说法的原因是
。
(2)农作物的生长对于土壤的酸碱性有一定的要求,有的喜酸性,有的喜碱性。适于一般农作物生长的PH在6.5-7.5之间,酸性或碱性过强都不利于作物的生长。土壤的碱性主要是由于土壤中的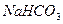 、
、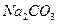 等盐类的水解而产生,请用离子方程式表示
等盐类的水解而产生,请用离子方程式表示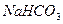 、
、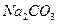 的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
的水解 ; 。指出土壤显酸性的可能原因(填出一条合理方案即可) 。
(3)土壤里发生着大量的氧化还原反应,许多氧化还原反应是在微生物存在的条件下进行的。如当土壤通气性良好时,土壤团粒的空隙里含有氧气,这时,在好气性微生物的作用下氧化反应得以顺利进行,土壤里的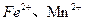 等被氧化为
等被氧化为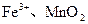 等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
等。从能量的转化角度来说,微生物的活动所需的能量来自 。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第二次月考化学试卷(解析版) 题型:填空题
近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
(2)足量B和C与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式 。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(16分)化学发展史上,有许多偶然事件引起科学发现的事例,碘的发现也得益于Courtoris对意外现象的注意。碘是人类发现的第二个生物必需微量元素,它以碘化物形式存在于海水、海藻及人体甲状腺中。人类缺碘会引起甲状腺肿大,我国已全面实施加碘盐方案。
3-1 单质碘的制备方法之一是在酸性条件下通Cl2于NaI溶液中,指出运用该法时应注意的问题?分析其原因,写出有关反应方程式。
3-2 在100%硫酸中,I2可被HIO3氧化成I3+,写出配平的离子方程式。
3-3 为什么在日照强、温度高的海区,表层水碘浓度往往要低一些?
3-4 人体缺碘会影响正常的生命活动。儿童缺碘会造成身体畸形,智力低下。成年人缺碘会因新陈代谢能力降低而导致全身无力,提早出现衰老现象。为提高人体素质,食物补碘已引起人们的重视。据报道,人从食物中摄取碘后便在甲状腺中积存下来,通过一系列化学反应形成甲状腺素。甲状腺素的结构:
(1)写出甲状腺素的化学式 ;
(2)在甲状腺内,甲状腺素的主要合成过程如下:
A(氨基酸)![]() B
B![]() 甲状腺素+C(氨基酸)
甲状腺素+C(氨基酸)
请写出A、B、C的结构简式。
3-5 科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活。目前预防缺碘的有效办法是食用含碘食盐。目前国内食盐加碘加的主要是碘酸钾。
(1)写出工业上以KI为原料制备碘酸钾的化学方程式;
(2)如何用简易操作检验食盐是否加碘。写出离子反应方程式。
3-6 已知反应H2+I2![]() 2HI,分两步完成I2
2HI,分两步完成I2![]() 2I H2+2I
2I H2+2I![]() 2HI
2HI
式中k,k1,k2,k3是分别为各反应相应的速率常数,若用Ea,E1,E2,E3分别表示各反应相应的活化能,请找出Ea和E1,E2,E3间的关系。已知公式如下:
①对于反应aA+bB→eE+f F,反应速率为:v=k[A]a[B]b
②速率常数与活化能之间满足阿仑尼乌斯公式:k=Ae-Ea/RT
③对于反应I2![]() 2I满足:v正=v逆
2I满足:v正=v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com