
根据硫化氢气体的实验室制法和性质完成下列填空.
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用________.
a.稀硫酸与硫化亚铁
b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠
d.稀盐酸与硫化亚铁
(2)现在组装一套可以控制硫化氧气体产生速率的装置,请在下图中选择合适的仪器;________(填编号)

(3)如下图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,点燃硫化氢气体.在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是________.

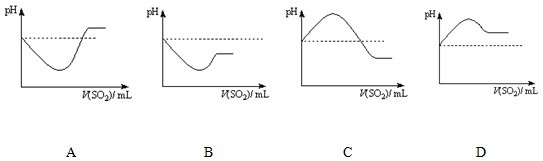
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:________反应过程中,溶液的pH________(填“变大”、“变小”或“不变”).
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置.下图的装置能起到此作用的是________.

(6)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸.当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是________.
科目:高中化学 来源: 题型:阅读理解
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 0.085cV |
| ρ |
| 0.085cV |
| ρ |
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 探究氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) |
产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) 产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) |
| 或探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) |
产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) 产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) |
查看答案和解析>>
科目:高中化学 来源:志鸿系列必修一训练化学苏教版 苏教版 题型:058
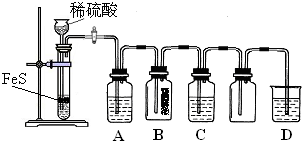
已知:①FeS不溶解于水 ②实验室制取H2S、SO2气体的原理是FeS+H2SO4![]() FeSO4+H2S↑,Na2SO3+H2SO4
FeSO4+H2S↑,Na2SO3+H2SO4![]() Na2SO4+H2O+SO2↑ ③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2
Na2SO4+H2O+SO2↑ ③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2![]() 3S↓+2H2O.
3S↓+2H2O.
根据下图中的实验装置和试剂进行实验,完成下列问题:

(1)装置A是由双孔塞、玻璃导管及________和________组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性和漂白性.
①按实验装置连接顺序,把a→f各导管口连接起来,正确的顺序有________.
A.befcda
B.adcefb
C.acdfeb
D.acdefb
②若C装置中的溶液为________,反应后该溶液变为无色,说明SO2具有还原性.
③若C装置中的溶液为________,反应后该溶液变为无色,说明SO2具有漂白性.
④当D中产生________现象时,说明SO2具有氧化性.
(3)D装置烧杯中NaOH溶液的作用是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(08年上海卷)![]() 设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( )
设计学生实验要注意安全、无污染、现象明显。根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见右图)。若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散)。下列气体的制取宜使用该装置的是( )
A.用二氧化锰(粉末)与双氧水制氧气 B.用锌粒与稀硫酸制氢气
C.用硫化亚铁(块状)与盐酸制硫化氢 D.用碳酸钙(块状)与稀硫酸制二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室制取硫化氢的化学方程式____________________________________。
(2)根据装置图完成下列问题。

①制取硫化氢气体的发生装置可以选用_____________。
②若用C装置收集硫化氢气体,进气口应为_____________,原因是___________________。
③为了验证硫化氢的水溶液呈酸性,可以将气体通入装置D,D中所盛的试剂应该是_____________,现象是_______________________。
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中漏斗的作用为____________________________。
⑤整套装置的连接口连接顺序为(填写a、b、c等符号)____________________。
(3)现用
①收集到的H2S气体的体积(标准状况)。
②溶液中Fe2+和H+的物质的量浓度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com