
【题目】聚合硫酸铁可用于水的净化,化学式可表示为[Fea(OH)b(SO4)c]m,取其与足量盐酸反应,所得溶液平均分为两份,一份溶液加入足量的BaCl2溶液,得到沉淀4.66 g。另一份溶液,加入足量的NaOH溶液后过滤,对滤出固体洗涤,后灼烧得到红棕色固体质量为1.6 g,该聚合硫酸铁样品中a∶b的比值是
A. 1∶1B. 2∶1C. 3∶1D. 2∶5
【答案】A
【解析】
利用BaSO44.66g可以求出硫酸根的质量,利用Fe2O3质量为1.6g可以求出铁元素的质量,依据反应前后元素的质量不变可知该聚合物中硫酸根和铁元素的质量之比,从而可知a和c的比,而后利用化合物中元素的化合价代数和为零可求出b的值,据此解答。
4.66gBaSO4中含硫酸根的质量是4.66g×![]() =1.92g,1.6gFe2O3中铁的质量为1.6g×
=1.92g,1.6gFe2O3中铁的质量为1.6g×![]() =1.12g,由质量守恒定律可知该聚合物中硫酸根和铁元素的质量比是1.92:1.12=12:7,故由聚合物的化学式可知
=1.12g,由质量守恒定律可知该聚合物中硫酸根和铁元素的质量比是1.92:1.12=12:7,故由聚合物的化学式可知![]() ,则
,则![]() =1:1,令a=1,c=1,则由化合物中化合价的代数和为零可得3a-b-2c=0,则b=1,则该聚合硫酸铁样品中a:b的比值是1:1,故答案为A。
=1:1,令a=1,c=1,则由化合物中化合价的代数和为零可得3a-b-2c=0,则b=1,则该聚合硫酸铁样品中a:b的比值是1:1,故答案为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
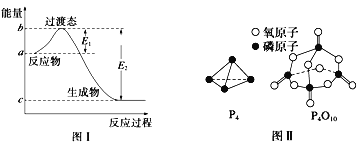
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”、“减小”或“不变”下同),△H的变化是________。请写出NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 用酒精作为萃取剂从溴水中提取溴
B. 分液时,下层液体下端流出,上层液体上口倒出
C. 蒸馏时,温度计的水银球应位于蒸馏烧瓶的支管口附近
D. 过滤时,漏斗的下端要紧靠烧杯的内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是

A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的含氧衍生物可以作为无铅汽油的抗爆震剂,它的相对分子质量不超过100,含C的质量分数为68.2%,含H的质量分数为13.6%,其余为氧。请计算回答:
(1)该化合物的相对分子质量是____________________。
(2)写出该化合物的分子式___________________________。
(3)若该化合物不能与钠反应产生氢气,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界瓷都——泉州德化盛产陶瓷,下列说法不正确的是( )
A.国产C919用到的氮化硅陶瓷是新型无机非金属材料
B.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
C.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
D.瓷器的青色来自氧化铁(Fe2O3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
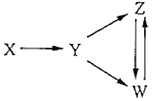
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com