
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
分析 A.由H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol可知水分解为吸热反应;
B.H2的燃烧热中应生成液态水;
C.浓硫酸溶于水放热;
D.醋酸为弱酸,电离吸热.
解答 解:A.由H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol可知水分解为吸热反应,且2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol,故A正确;
B.H2的燃烧热中应生成液态水,H2的燃烧热大于241.8 KJ/mol,故B错误;
C.浓硫酸溶于水放热,浓硫酸与氢氧化钠溶液反应生成1molH2O(l),放出热量大于57.3KJ,故C错误;
D.醋酸为弱酸,电离吸热,则稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ,故D正确.
故选AD.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握反应热、中和热的定义,把握热化学方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质微粒直径在10-9 m~10-7m之间 | |
| B. | 用聚光手电筒照射CuSO4溶液和Fe(OH)3胶体时,产生的现象相同 | |
| C. | 将5-6滴饱和FeCl3溶液加入到沸水中继续加热至溶液呈红褐色制得了Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:2H2+4OH--4e-═4H2O | |
| B. | 正极反应为:O2+4H++4e-═2 H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
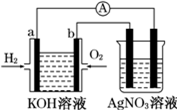 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com