
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
科目:高中化学 来源: 题型:单选题
以下说法错误的是
| A.物质所含元素化合价升高的反应叫氧化反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂 |
| C.含非金属元素的离子,在氧化还原反应中一定作还原剂 |
| D.非金属原子越容易得到电子,其单质氧化性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
| A.浓硫酸的体积增大 | B.氢氧化钠的表面发生潮解 |
| C.铝的表面生成致密的薄膜 | D.澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH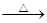 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O
若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0.08 mol单质硫与含0.06 mol KOH的热溶液充分反应恰好生成a mol K2Sx和b mol K2S2O3,再加入足量KClO-KOH的混合溶液,硫元素全部转化为K2SO4,转移电子n mol。则以下正确的是
| A.a = 2b | B.x = 2 | C.n = 0.48 | D.b = 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
| A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.N中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了测定铜铁合金中铜的质量分数,在10.00g试样中加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属7.48g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属6.60g。若硝酸的还原产物只有NO,下列说法正确的是
| A.上述测定不能达到实验目的 | B.剩余的7.48g金属为铜 |
| C.共生成NO气体 0.04mol | D.该合金中铜的质量分数为69.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2=" NO" +SO3,在体积为V L的密闭容器中通入3molNO2和5molSO2, 反应后容器内氮原子和氧原子个数比为( )
| A.3/10 | B.16/3 | C.3/16 | D.5/16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.Cu2S既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应时有10 mol电子转移 |
C.产物中的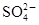 有一部分是氧化产物 有一部分是氧化产物 |
| D.FeS2只作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com