
某实验兴趣小组设计如下微型实验装置。实验时,先断开S2,闭合S1,两极均有气泡产生;一段时间后,断开S1,闭合S2,发现电流表A的指针偏转,下列有关描述正确的是

A.断开S2闭合S1时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑
H2↑+Cl2↑
B.断开S2闭合S1时,阳极附近溶液变红
C.断开S1闭合S2时,铜电极上的电极反应为:Cl2+2e→2Cl-
D.断开S1闭合S2时,石墨电极作正极
D
【解析】
试题分析:A、断开S2,闭合S1时,是电解池装置,两极均有气泡产生,说明是电解饱和食盐水的反应,反应的离子方程式为2H2O+2Cl- Cl2↑+H2↑+2OH-;故A错误;B、断开S2,闭合S1时,是电解池装置,两极均有气泡产生,石墨做阳极,溶液中氯离子离子失电子发生氧化反应,铜做阴极,氢离子得到电子发生还原反应,依据水的电离平衡,氢氧根离子浓度增大酚酞变红;故B错误;C、断开S1,闭合S2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,铜做负极发生氢气失电子生成氢离子的反应;故C错误D、断开S1,闭合S2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,石墨做原电池正极;故D正确。
Cl2↑+H2↑+2OH-;故A错误;B、断开S2,闭合S1时,是电解池装置,两极均有气泡产生,石墨做阳极,溶液中氯离子离子失电子发生氧化反应,铜做阴极,氢离子得到电子发生还原反应,依据水的电离平衡,氢氧根离子浓度增大酚酞变红;故B错误;C、断开S1,闭合S2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,铜做负极发生氢气失电子生成氢离子的反应;故C错误D、断开S1,闭合S2时,发现电流表指针偏转,证明是原电池反应,形成氢氯燃料电池,石墨做原电池正极;故D正确。
考点:原电池和电解池的工作原理


科目:高中化学 来源: 题型:
 如图是某化学兴趣小组设计的制取溴苯的实验装置,装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭).试回答下面的问题:
如图是某化学兴趣小组设计的制取溴苯的实验装置,装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭).试回答下面的问题:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
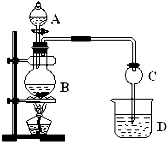 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com