
”¾ĢāÄæ”æijµ„Ļ©ĢžA£ØC8H16£©æÉŅŌ·¢ÉśČēĻĀĶ¼Ź¾µÄ×Ŗ»Æ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ

ŅŃÖŖ£ŗ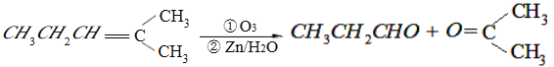
£Ø1£©BµÄ·Ö×ÓŹ½ĪŖ___________________£¬DÖŠŗ¬ÓŠ¹ŁÄÜĶŵÄĆū³Ę___________________”£
£Ø2£©BĪŽŅų¾µ·“Ó¦£¬ DŌŚÅØĮņĖį“ęŌŚĻĀ¼ÓČČæɵƵ½ÄÜŹ¹äåĖ®ĶŹÉ«ĒŅÖ»ÓŠŅ»ÖÖ½į¹¹µÄĪļÖŹE£Ø²»æ¼ĀĒĮ¢ĢåŅģ¹¹£©£¬ĒėŠ“³ö£ÅµÄ½į¹¹¼ņŹ½____________________________________£¬£Ä”ś£ÅµÄ·“Ó¦ĄąŠĶ___________________________”£
£Ø3£©Š“³öC”śFµÄ»Æѧ·½³ĢŹ½_________________________________”£
£Ø4£©HµÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬Āś×ćĻĀĮŠŅŖĒóµÄ½į¹¹Ņ»¹²ÓŠ____________Ö֣ز»æ¼ĀĒĮ¢ĢåŅģ¹¹£¬°üĄØH±¾Éķ£©
¢ŁŹōÓŚõ„Ąą£»¢ŚĖįŠŌĢõ¼žĻĀĖ®½āÄܵƵ½Ļą¶Ō·Ö×ÓÖŹĮæĪŖ74µÄÓŠ»śĪļ
£Ø5£©ŅŃÖŖ£ŗ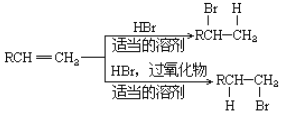 ”£
ӣ
ĒėŠ“³öÓÉCÖʱø2-±ū“¼µÄŗĻ³ÉĀ·Ļß_____________________£ØĪŽ»śŌĮĻČĪŃ”£©”£ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾ĄżČēĻĀ£ŗ![]()
”¾“š°ø”æ £©C5H10O ōĒ»ł CH3CH= CHCH2CH3 ĻūČ„·“Ó¦ CH3CH2CHO+2Ag£ØNH3£©2OH![]() CH3CH2COONH4+3NH3+2Ag”ż+H2O 16
CH3CH2COONH4+3NH3+2Ag”ż+H2O 16 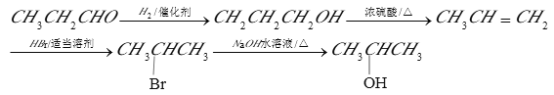
”¾½āĪö”æ±¾ĢāÖ÷ŅŖæ¼²éÓŠ»śĪļµÄ½į¹¹ÓėŠŌÖŹ”£
£Ø1£©B·Ö×Óŗ¬ÓŠ5øöĢ¼Ō×Ó£¬BµÄ·Ö×ÓŹ½ĪŖC5H10O£¬DÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅŹĒōŹ»ł¼ÓĒāŠĪ³ÉµÄ£¬Ćū³ĘŹĒōĒ»ł”£
£Ø2£©DŹĒ3”ŖĪģ“¼£¬£ÅµÄ½į¹¹¼ņŹ½ĪŖCH3CH=CHCH2CH3£¬£Ä”ś£Å·¢Éś“¼µÄĻūČ„·“Ó¦£¬·“Ó¦ĄąŠĶĪŖĻūČ„·“Ó¦”£
£Ø3£©CæÉÓėŅų°±ČÜŅŗ·¢Éś·“Ó¦£¬CŹĒ±ūČ©£¬£Ć”ś£ĘµÄ»Æѧ·½³ĢŹ½ĪŖCH3CH2CHO+2Ag£ØNH3£©2OH![]() CH3CH2COONH4+3NH3+2Ag”ż+H2O”£
CH3CH2COONH4+3NH3+2Ag”ż+H2O”£
£Ø4£©¢ŁøĆĶ¬·ÖŅģ¹¹ĢåŹōÓŚõ„Ąą£»¢ŚøĆĶ¬·ÖŅģ¹¹ĢåŌŚĖįŠŌĢõ¼žĻĀĖ®½āµĆµ½±ūĖį»ņ¶”“¼”£µ±øĆĶ¬·ÖŅģ¹¹ĢåĪŖ±ūĖįĪģõ„Ź±£¬ÓÉÓŚĪģ“¼ÓŠ8ÖÖ£¬ĖłŅŌ±ūĖįĪģõ„ÓŠ8ÖÖ£»µ±øĆĶ¬·ÖŅģ¹¹ĢåĪŖ¶”Ėį¶”õ„Ź±£¬ÓÉÓŚ¶”ĖįÓŠ2ÖÖ£¬¶”“¼ÓŠ4ÖÖ£¬ĖłŅŌ¶”Ėį¶”õ„ÓŠ8ÖÖ”£¹²16ÖÖ”£
£Ø5£©ÓɱūČ©ÖʱøÖʱø2-±ū“¼µÄŗĻ³ÉĀ·Ļߣŗ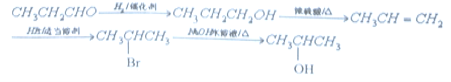 ”£
ӣ


 ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø
ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø ³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø
³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø »ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø
»ĘøŌ360¶Č¶ØÖĘĆܾķĻµĮŠ“š°ø Ńō¹āæ¼³”µ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āæ¼³”µ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø ĆūŠ£ĮŖĆĖ³å“Ģ¾ķĻµĮŠ“š°ø
ĆūŠ£ĮŖĆĖ³å“Ģ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÅäÖĘ100 mL 1 molL©1ĒāŃõ»ÆÄĘČÜŅŗ£¬ĻĀĮŠ²Ł×÷“ķĪóµÄŹĒ£Ø £©
A.ŌŚĶŠÅĢĢģĘ½ÉĻ·ÅĮ½Ę¬“óŠ””¢ÖŹĮæĻąĶ¬µÄÖ½£¬Č»ŗó½«ĒāŃõ»ÆÄĘ·ÅŌŚÖ½Ę¬ÉĻ½ųŠŠ³ĘĮæ
B.°Ń³ĘŗƵÄNaOH·ÅČėŹ¢ÓŠŹŹĮæÕōĮóĖ®µÄÉÕ±ÖŠ£¬Čܽā”¢ĄäČ“£¬ŌŁ°ŃČÜŅŗŅĘČėČŻĮæĘæÖŠ
C.ÓĆÕōĮóĖ®Ļ“µÓÉÕ±”¢²£Į§°ō2”«3“Ī£¬Ļ“µÓŅŗŅ²ŅĘČėČŻĮæĘæÖŠ
D.ŃŲ×Ų£Į§°ōĶłČŻĮæĘæÖŠ¼ÓČėÕōĮóĖ®£¬µ½ĄėæĢ¶ČĻß2”«3 cmŹ±øÄÓĆ½ŗĶ·µĪ¹ÜµĪ¼Ó£¬Ö±µ½ČÜŅŗ°¼ŅŗĆęĒ”ŗĆÓėæĢ¶ČĻßĻąĒŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æB”¢D”¢C”¢A”¢E ĪåÖÖŌŖĖŲµÄŌ×ÓŠņŹżĖ³ŠņŅĄ“ĪŌö“ó£¬ĘäÖŠÖ»ÓŠEĪŖ½šŹōŌŖĖŲ£¬D”¢C ŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠĪ»ÖĆĻąĮŚ£¬ŌŚŅ»¶ØĢõ¼žĻĀ£¬B µÄµ„ÖŹæÉŅŌ·Ö±šŗĶA”¢C”¢D µÄµ„ÖŹ»ÆŗĻÉś³É¼×”¢ŅŅ”¢±ū»ÆŗĻĪļ£¬C µÄµ„ÖŹŗĶD µÄµ„ÖŹ»ÆŗĻæɵƶ”£¬Īģ”¢¼ŗ”¢øż¾łĪŖ»ÆŗĻĪļ”£ŅŃÖŖŅŅ”¢±ūĆæøö·Ö×ÓÖŠ¾łŗ¬ÓŠ10 øöµē×Ó£¬ĻĀĶ¼ĪŖĻą»„×Ŗ»Æ¹ŲĻµ£ŗ
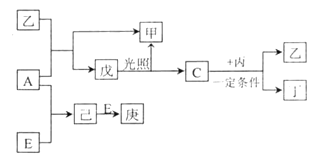
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öE µÄŌ×Ó½į¹¹Ź¾ŅāĶ¼_____________”£
£Ø2£©Š“³öC”¢D Ēā»ÆĪļµÄĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³Šņ_________£ØÓĆ»ÆѧŹ½±ķŹ¾£©”£
£Ø3£©A”¢B”¢D ČżÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠĘäÖŠŅ»ÖÖæÉÓĆ×÷»Æ·Ź£¬Š“øĆ»ÆŗĻĪļµÄµē×ÓŹ½__________”£
£Ø4£©Š“³öCÓė±ū·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½________________”£
£Ø5£©Š“³ö¹¤ŅµÉĻ“Óŗ£Ė®ÖŠÖĘČ”A µÄĄė×Ó·“Ó¦·½³ĢŹ½_______________”£
£Ø6£©¹¤ŅµÉĻĶعżČēĻĀ×Ŗ»ÆæÉÖʵĆŗ¬A ŌŖĖŲµÄ¼ŲŃĪKAO3 ¾§Ģå:
NaAČÜŅŗ![]() NaAO3
NaAO3![]() KAO3¾§Ģå
KAO3¾§Ģå
¢ń ¢ņ
¢ŁĶź³É¢ńÖŠ·“Ó¦µÄ×Ü»Æѧ·½³ĢŹ½:___________________”£
NaA+”õH2O![]() ”õNaAO3+”õ
”õNaAO3+”õ
¢Ś¢ņÖŠ·“Ó¦¹ż³ĢÄÜĪö³öKClO3¾§Ģå¶ųĪŽĘäĖū¾§ĢåĪö³öµÄŌŅņŹĒ_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ°“ÕÕ“æ¾»Īļ£¬»ģŗĻĪļ£¬µē½āÖŹŗĶ·Ēµē½āÖŹµÄĖ³ŠņÅÅĮŠµÄŹĒ
A.ŃĪĖį£¬Ė®ĆŗĘų£¬“×Ėį£¬øɱłB.±ł“×Ėį£¬ŃĪĖį£¬ĮņĖįÄĘ£¬ŅŅ“¼
C.æĮŠŌÄĘ£¬ŹÆ»ŅŹÆ£¬Ģś£¬ĮņĖį±µD.µØ·Æ£¬ĘÆ°×·Ū£¬ĀČ»Æ¼Ų£¬ĀČĘų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘÆ°×·ŪŌŚæÕĘųÖŠČŻŅ׏§Š§µÄŌŅņŹĒ
A. “ĪĀČĖįøĘ²»ĪČ¶Ø£¬Ņ×·Ö½ā B. ĀČ»ÆøĘŅ׳±½ā
C. “ĪĀČĖįøĘŅ×ÓėŃĪĖį·“Ó¦ D. “ĪĀČĖįøĘŅ×ŗĶæÕĘųÖŠµÄĖ®¼°¶žŃõ»ÆĢ¼·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČżøöĢå»ż¾łĪŖ0.5LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗCO(g)+Cl2(g)![]() COCl2(g)ĘäÖŠČŻĘ÷¢ńÖŠ5minŹ±µ½“ļĘ½ŗā”£
COCl2(g)ĘäÖŠČŻĘ÷¢ńÖŠ5minŹ±µ½“ļĘ½ŗā”£
ČŻĘ÷±ąŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼ĪļÖŹµÄĮæ/mol | Ę½ŗāĪļÖŹµÄĮæ/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
¢ń | 500 | 1.0 | 1.0 | 0 | 0.8 |
¢ņ | 500 | 1.0 | a | 0 | 0.5 |
¢ó | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ČŻĘ÷¢ńÖŠĒ°5minµÄÖŠ·“Ó¦ĖŁĀŹv(CO)=0.16mol”¤L-1”¤min-1
B. øĆ·“Ó¦µÄÕż·“Ó¦ĪŖĪüČČ·“Ó¦
C. ČŻĘ÷¢ņÖŠĘšŹ¼Ź±Cl2µÄĪļÖŹµÄĮæĪŖ0.55mol
D. ČōĘšŹ¼Ź±¼äČŻĘ÷¢ńÖŠ¼ÓČėCO0.8mol”¢Cl20.8mol£¬“ļµ½Ę½ŗāŹ±COµÄ×Ŗ»ÆĀŹ“ó80%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠŗ¬MgCl2ŗĶAlCl3ø÷0.01mol£¬ĻņĘäÖŠÖšµĪ¼ÓČė1mol/LµÄNaOHČÜŅŗÖĮ¹żĮ棬ĻĀĮŠ¹ŲĻµĶ¼ÕżČ·µÄŹĒ£Ø £©
A.
B.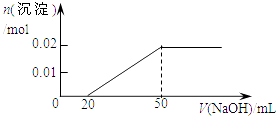
C.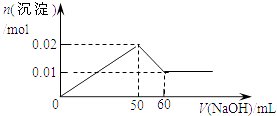
D.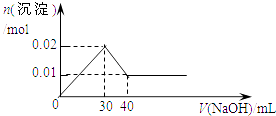
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃ¹Ēæ±ä»Æ²»»įŹ¹ĻĀĮŠ»Æѧ·“Ó¦µÄĘ½ŗā·¢ÉśŅĘ¶ÆµÄŹĒ ( £©
A. H2(Ęų)£«I2(Ęų) ![]() 2HI(Ęų)
2HI(Ęų)
B. 3H2(Ęų)£«N2(Ęų) ![]() 2NH3(Ęų)
2NH3(Ęų)
C. 2SO2(Ęų)£«O2(Ęų) ![]() 2SO3(Ęų)
2SO3(Ęų)
D. C(¹Ģ)£«CO2(Ęų) ![]() 2CO(Ęų)
2CO(Ęų)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ׏ĮĻĻŌŹ¾”°O2µÄŃõ»ÆŠŌĖęČÜŅŗpHµÄŌö“óÖš½„¼õČõ”±”£Ä³ŠĖȤŠ”×éĢ½¾æ²»Ķ¬Ģõ¼žĻĀKIÓėO2µÄ·“Ó¦£®ŹµŃéČēĻĀ”£
×°ÖĆ | ÉÕ±ÖŠµÄŅŗĢå | ĻÖĻó£Ø5·ÖÖÓŗó£© |
| ¢Ł2 mL1 mol/LKIČÜŅŗ+5µĪµķ·Ū | ĪŽĆ÷ĻŌ±ä»Æ |
¢Ś2 mL1 mol/LKIČÜŅŗ+5µĪµķ·Ū+2 mL0.2 mol/L HCl | ČÜŅŗ±äĄ¶ | |
¢Ū2 mL1 mol/LKIČÜŅŗ+5µĪµķ·Ū+2 mL0.2 mol/L KCl | ĪŽĆ÷ĻŌ±ä»Æ | |
¢Ü2 mL1 mol/LKIČÜŅŗ+5µĪµķ·Ū+2 mL0.2 mol/L CH3COOH | ČÜŅŗ±äĄ¶£¬ŃÕÉ«½Ļ¢ŚĒ³ |
£Ø1£©ŹµŃé¢ŚÖŠÉś³ÉI2µÄĄė×Ó·½³ĢŹ½ŹĒ___________”£
£Ø2£©ŹµŃé¢ŪµÄÄæµÄŹĒ_________________________________________________________________”£
£Ø3£©ŹµŃé¢Ü±Č¢ŚČÜŅŗŃÕÉ«Ē³µÄŌŅņŹĒ________”£
£Ø4£©ĪŖ½ųŅ»²½Ģ½¾æKIÓėO2µÄ·“Ó¦£¬ÓĆÉĻ±ķÖŠµÄ×°ÖĆ¼ĢŠų½ųŠŠŹµŃé£ŗ
ÉÕ±ÖŠµÄŅŗĢå | ĻÖĻó£Ø5Š”Ź±ŗó£© |
¢Ż2 mLpH=8.5»ģÓŠKOHµÄ1mol/L KIČÜŅŗ+5µĪµķ·Ū | ČÜŅŗ²ÅĀŌ±äĄ¶ |
¢Ž2 mLpH=10»ģÓŠKOHµÄ1mol/L KIČÜŅŗ+5µĪµķ·Ū | ĪŽĆ÷ĻŌ±ä»Æ |
I£®¶ŌÓŚŹµŃ颎µÄĻÖĻó£®¼×Ķ¬Ń§Ģį³ö²ĀĻė”°pH=10Ź±O2²»ÄÜŃõ»ÆI-”±£¬Éč¼ĘĮĖĻĀĮŠ×°ÖĆ½ųŠŠŹµŃ飬ŃéÖ¤²ĀĻė”£

i£®ÉÕ±aÖŠµÄČÜŅŗĪŖ____”£
ii£®ŹµŃé½į¹ū±ķĆ÷£¬“Ė²ĀĻė²»³ÉĮ¢”£Ö§³ÖøĆ½įĀŪµÄŹµŃéĻÖĻóŹĒ£ŗĶØČėO2ŗó£¬_______”£
¢ņ£®ŅŅĶ¬Ń§ĻņpH=10µÄKOHČÜŅŗ£Øŗ¬µķ·Ū£©ÖŠµĪ¼ÓµāĖ®£¬ČÜŅŗĻȱ䥶ŗóŃøĖŁĶŹÉ«£®¾¼ģ²āĶŹÉ«ŗóµÄČÜŅŗÖŠŗ¬ÓŠIO3-£¬ĶŹÉ«µÄŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©____________”£
£Ø5£©øĆŠ”×éĶ¬Ń§¶ŌŹµŃé¹ż³Ģ½ųŠŠĮĖÕūĢå·“Ė¼£®ĶĘ²āŹµŃé¢ŁµÄĻÖĻó²śÉśµÄŌŅņæÉÄÜŹĒ______£»ŹµŃ颎µÄĻÖĻó²śÉśµÄŌŅņæÉÄÜŹĒ_______”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com