
工业接触法制硫酸的简单流程图如下: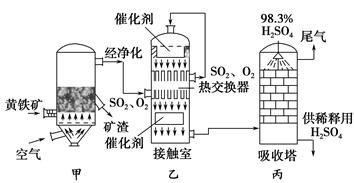
(1)写出装置甲的名称________。要使黄铁矿充分和迅速地燃烧,工业上常采取的措施为__________________________________。
(2)接触室中二氧化硫与氧气的反应采用________(填“常压”或“高压”),原因是________________________________。
(3)刚通入接触室中的SO2和O2在热交换器的管道________(填“里”或“外”)流动,在催化剂表面接触反应的SO2和O2在热交换器的管道________(填“里”或“外”)流动,这样两种流体通过管壁进行热交换。
(4)在吸收塔中为什么用98.3%的浓硫酸而不是用水吸收三氧化硫?
______________________________________________________________。
(5)工业接触法制硫酸的过程中,有两个操作过程采用了逆流的原理,它们分别是_____________________________________
科目:高中化学 来源: 题型:单选题
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按如下图所示流程制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。图中反应(Ⅰ)为氟磷灰石跟另一种原料反应,生成A、B、C三种物质,其中的产物C又跟氟磷灰石发生反应(Ⅱ),生成B和重过磷酸钙。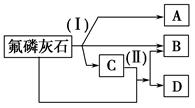
试写出两个反应的化学方程式:反应(Ⅰ)______________;反应(Ⅱ)___ _______
在生产中要特别注意_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸: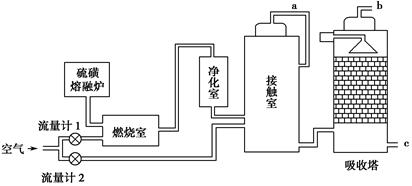
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_______________________。
②为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
③与以黄铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少
B.二氧化硫的转化率提高
C.生产的废渣减少
D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列关于工业生产说法正确的是 。(填序号)
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
| pH | Ca2+ 、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | < 0.004 5 mol·L-1? | <100个·mL-1? |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为: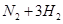


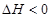 。
。
①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。
③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为
你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年度诺贝尔化学奖再次授予计算化学领域的科学家。以下基于结构理论进行繁难计算得出的是
| A.天然气的热值 | B.合成氨的原子利用率 |
| C.尿素的含氮量 | D.p轨道电子云的形状 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Na+2H2O=2NaOH+H2↑ | B.Cl2+H2O=HCl+HClO |
| C.2F2+2H2O=4HF+O2 | D.CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了进一步提高合成氨的生产效率,科研中具有开发价值的是 ( )。
| A.研制高温下活性较大的催化剂 |
| B.寻求NH3的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温高压的新型材料建造合成塔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com