
| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
分析 A.胶体粒子是大量氢氧化铁的聚集体;
B.胶体能透过半透膜;
C.胶体能发生丁达尔效应;
D.当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm).
解答 解:A.胶体粒子是大量氢氧化铁的聚集体,所以含0.001 mol FeCl3溶质的溶液形成胶体后,胶体粒子小于0.001 mol,故A错误;
B.胶体颗粒较小能透过半透膜,故B错误;
C.胶体有丁达尔效应,溶液无丁达尔效应,故C正确;
D.当分散剂是水或其它溶液时,分散质粒子直径大小在1nm~100nm之间的是胶体,故D错误.
故选C.
点评 本题考查了分散系溶液、浊液、胶体的区别,胶体的性质等,注意相关基础知识的积累,题目难度不大.


科目:高中化学 来源: 题型:解答题
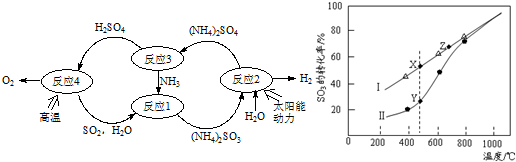
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 164.1 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
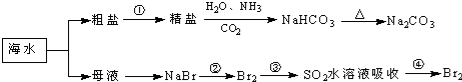
| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 在第②、④步骤中,溴元素均被氧化 | |
| C. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| D. | 制取NaHCO3的反应是利用其溶解度小于NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O-12e-═2CO2+12H+ | |
| B. | 反应一段时间后,两池溶液的pH均未变化 | |
| C. | 假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol | |
| D. | 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表前四周期,其中的字母代表相应的元素.
如表为元素周期表前四周期,其中的字母代表相应的元素.| a | |||||||||||||||||
| b | c | d | |||||||||||||||
| e | f | g | k | ||||||||||||||
| h | I | j |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com