
| ① | ② | ③ | 实验结论 | 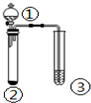 | |
| A | 盐酸 | Na2S | 硫酸铜溶液 | 稳定性:HCl>H2S | |
| B | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 | |
| C | 浓硫酸 | C | 澄清石灰水 | 浓硫酸具有强氧化性 | |
| D | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| A. | A | B. | B | C. | C | D. | D |
分析 A.实验只能比较HCl、H2S酸性强弱;
B.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,淀粉碘化钾变蓝色,可说明生成碘;
C.浓硫酸和碳应在加热条件下反应;
D.硝酸易挥发,不能排出硝酸的影响,且KI具有还原性.
解答 解:A.气体通入硫酸铜溶液生成黑色沉淀,说明生成H2S,实验只能比较HCl、H2S酸性强弱,不能比较比较稳定性,故A错误;
B.浓盐酸与高锰酸钾发生氧化还原反应生成氯气,淀粉碘化钾变蓝色,可说明生成碘,可说明氧化性KMnO4>Cl2>I2,故B正确;
C.浓硫酸和碳应在加热条件下反应,常温下不生成二氧化碳气体,故C错误;
D.硝酸易挥发,不能排出硝酸的影响,且KI具有还原性,不能比较NO2、KI的氧化性,故D错误.
故选B.
点评 本题考查较为综合,为高考常见题型,侧重学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性、可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃煤中加入CaO后可减少温室气体的排放量 | |
| B. | 糖类、油脂、蛋白质都是人类重要的营养物质,均属于天然高分子化合物 | |
| C. | 漂白粉、明矾均可用于饮用水处理,其化学原理相同 | |
| D. | 在全球每年被腐蚀的金属中,电化学腐蚀比化学腐蚀所占比例高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.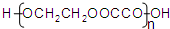 .
.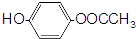 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 电解饱和氯化钠溶液,产生气体:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
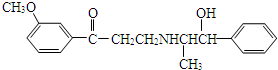
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:简答题
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第IIIA族),他们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子占据的最高能层符号为________,基态铝原子有____个不同能级;基态镓原子的核外电子排布式为 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
(3)晶体硼的结构单元是正二十面体的原子晶体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,则这个基本结构单元由____个1硼原子组成,共含有____B-B键。
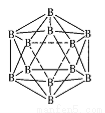
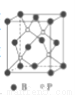
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过高温氢气氛围下(750℃)三溴化硼和三溴化磷反映值得的。BP晶胞如图所示。
①在BP晶胞中B的堆积方式为____。
②当晶胞晶格参数为acm(即途中立方体的每条边长为acm)时,磷化硼晶胞的密度为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com